Что такое андрогенная блокада при раке простаты
Лечение рака предстательной железы
За последнее десятилетие заболеваемость выросла двукратно, рак простаты сегодня занимает второе место в рейтинге мужских раков.
Правда, сегодня нельзя сказать, что это истинный рост заболеваемости, повсеместное скрининговое определение опухолевого маркёра — простат-специфического антигена выявляет опухоли в столь ранней стадии, что большинству пациентов просто не удастся дожить до клинических проявлений рака.
Рак простаты был далеко не первым заболеванием, которое начали лечить гормонами. До Второй мировой войны выяснилась зависимость рака простаты от тестостерона, то есть опухолевым клеткам для жизнедеятельности требуются андрогены.
Удаление яичек и женские половые гормоны — эстрогены продемонстрировали очень хороший результат при метастазах в кости.
Тогда и стали рекомендовать гормонотерапию при начальных и поздних стадиях заболевания, когда невозможна была радикальная операция — простатэктомия.
Со временем выяснилось, что лечение сопровождается весьма серьёзными осложнениями со стороны сердечно-сосудистой системы и часть пациентов гибнет не от рака, который замедляется в своём развитии, а от острых инфарктов и тяжёлой сердечной недостаточности, индуцируемых эстрогенами. На смену эстрогенам пришли новые препараты, эстрогены перевели во «второй эшелон», когда к другим препаратам у опухоли простаты развивается устойчивость.
Гормонотерапия при раке предстательной железы, метастатическом и прогрессировании первичной опухоли, используется как совершенно самостоятельный метод. Она может быть немедленной или отсроченной, постоянной или прерывистой, самостоятельной или комбинированной.Главный принцип — снижение уровня циркулирующих андрогенов, что достигается хирургическим удалением яичек, лекарственной кастрацией с помощью ЛГРГ, антиандрогенами или комбинацией методов.
Окончательный выбор «самого лучшего» способа лечения не сделан, поскольку нет ясности с эффективностью каждого метода в отдельности.
Хирургия: двусторонняя орхэктомия
Вся лечебная тактика при раке простаты направлена на снижение уровня андрогенов в крови — андрогенной блокаде.
Наряду с эстрогенотерапией также широко начала использоваться кастрация — двусторонняя орхэктомия, которая и сегодня находится в ряду ведущих лечебных мероприятий при раке предстательной железы.
При удалении яичек уже на вторые сутки уровень тестостерона крови падает на 90%, и что немаловажно для длительно протекающего злокачественного процесса — безвозвратно.
Двусторонняя или, правильнее, билатеральная орхэктомия стала «золотым стандартом» андрогенной блокады, поэтому все методы терапии рака предстательной железы сравнивают с эффективность хирургической кастрации.
Операция малотравматична и не требует наркоза, достаточно местного обезболивания, но психологически воспринимается как жизненная катастрофа.
С учётом этого возможно не полное удаление яичек — полная орхэктомия, а оставление оболочки и придатка яичка — субкапсулярная орхэктомия, что создаёт в мошонке «эффект присутствия» при возможности полной реализации терапевтического результата.
Химическая кастрация
Отказ от хирургической кастрации по причине психологического неприятия манипуляции отмечается довольно часто, для некоторых мужчин жизнь без яичек хуже смерти.
В таких вариантах используется лекарственное выключение функции яичек, действующее только во время использования специальных препаратов со сложным названием «аналоги гонадотропин-рилизинг гормона» или коротенько «аналоги ЛГРГ».
Это гозерелин, лейпролин и декапептил, каждый из которых имеет множество торговых наименований.
Лекарства эти структурно похожи на гормон ЛГРГ или гонадорелин, выделяемый гипоталамусом и стимулирующий переднюю долю гипофиза к выработке двух гонадотропных гормонов: стимулирующего образование сперматозоидов фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ), помогающего синтезу тестостерона.Тестостерон тоже вместе с ФСГ подключается к стимуляции развития сперматозоидов. Лекарства аналоги ЛГРГ прекращают эту круговую стимуляцию стимуляций, создавая гормональный фон почти кастрационного уровня.
Почти как после удаления яичек, но не совсем так, потому что в первые недели происходит серьёзное увеличение концентрации ФСГ и ЛГ, что сопровождается всплеском клинической симптоматики — «синдром вспышки». При синдроме вспышки резко усиливаются все признаки опухоли и даже появляются такие, о которых пациент и не подозревал.
Прежде всего, это интенсивные боли везде, где только есть опухолевые узлы. Не рекомендуется назначение аналогов ЛГРГ при вероятности развития этого крайне тяжёлого синдрома, для уменьшения «вспышки» одномоментно краткосрочно назначают антиандрогены.
Антиандрогены в лечении рака простаты
Антиандрогены прекращают доступ тестостерона внутрь опухолевой клетки, поскольку гораздо быстрее и сильнее связываются с рецептором на поверхности клеточного ядра. Без поступления тестостерона внутрь ядра клетка гибнет.
Применяются два структурных вида антиандрогенов, каждый из видов имеет несколько международных непатентованных наименований (МНН) и десятки торговых наименований. Хотя сравнительных исследований антиандрогенов не проводилось, принципиальных различий в эффективности нет.
Токсичность у одного препарата больше, у другого меньше, но тоже схожая.
Блокируя доступ тестостерона внутрь клеточного ядра, антиандрогены никак не влияют на его выработку, поэтому в крови тестостерон не только не падает, но и увеличивается.
Обманутые лекарством клетки требуют тестостерона, его выработка увеличивается, но до ядра он дойти не может.
Конечно, принимающий антиандрогены пациент избегает всего того, что вызывает кастрация: снижение либидо, разрежение костной структуры, снижение мышечной массы и физической активности.
Но повышение уровня циркулирующего в крови тестостерона отзывается увеличением молочных желёз, страдает печень и желудочно-кишечный тракт, а обещанное сохранение сексуальной активности на практике достаётся не всем, а только каждому пятому.
И самое важное, эффективность антиандрогенов уступает результативности кастрации хирургической и лекарственной.
Почему так происходит, когда теоретически блокировка доступа тестостерона внутрь клеточного ядра опухолевой клетки должна приводить к лучшему результату, чем просто снижение выработки гормона? Есть несколько предположений.
- Антиандрогены требуют регулярного приёма, что подчас не соблюдается, во всяком случае, многочисленные исследования уловили это системное нарушение.
- При кастрации уровень выработки тестостерона снижается очень надёжно, антиандрогены приводят не только к увеличению его примерно в полтора раза больше нормы, но и уровень нестабилен.
- Есть предположение, что чем больше очагов опухоли, тем больше рецепторов, терапевтическая доза не позволяет 100% охвата всех рецепторов.
Максимальная андрогенная блокада (МАБ)
При лечении рака предстательной железы онкологами предпринимается всё возможное для подавления роста опухоли, поэтому естественно было попробовать соединить вместе кастрацию и антиандрогены не временно для подавления «синдрома вспышки», а для потенцирования эффекта. И это было сделано в одном исследовании 1986 года, результат был фантастическим: 94 опухоли из сотни уменьшились, остальные тоже прекратили свой рост. Правда, никогда больше никому не удалось повторить этот сногсшибательный результат, но от МАБ не отказались.
Некоторые сравнительные исследования демонстрировали преимущество МАБ над любой кастрацией по продолжительности жизни больных с распространённым метастатическим процессом, другие не находили отличий в эффекте, подчёркивая более выраженную токсичность максимальной блокады. С токсичностью понятно, каждый из входящих в систему компонентов оставляет за собой все нежелательные явления, а вот суммации эффекта не происходит. Тем не менее, практически в течении 2 лет удаётся контролировать опухоль почти у 80% пациентов, но не без осложнений.
Гормональная терапия распространённого или метастатического рака не способна вылечить, но способна продлить жизнь пациента, и довольно значительно — на годы. Вопрос в качестве этой жизни, поэтому принципиально сегодня рекомендуется выбирать наиболее приемлемую для пациента терапию.
Для подбора лучшей клиники позвоните нам по номеру +7 (495) 023-10-24.
Источник: https://mednavi.ru/rak-predstatelnoj-zhelezy/
Андрогенная блокада рака предстательной железы что это такое

Мочеполовая система » Потенция » Андрогенная блокада рака предстательной железы что это такое
Роль максимальной андрогенной блокады в лечении больных диссеминированным раком предстательной железы
Рак предстательной железы (РПЖ) является одной из наиболее распространенных форм злокачественных опухолей у мужчин. В связи с особенностями клинического течения и несовершенством ранней диагностики от 60 до 80% больных РПЖ при первичном обращении имеют метастазы.
Для повышения эффективности лечения и улучшения качества жизни этой группы больных в последние годы разработаны новые гормональные препараты, среди которых внимание клиницистов привлекают антиандрогены и аналоги гонадотропин-рилизинг гормона, а также их комбинация, получившая название «максимальная андрогенная блокада» (МАБ). Опыт лечения пациентов с диссеминированным РПЖ с использованием МАБ показал высокую эффективность данной комбинации, практическое отсутствие побочных проявлений, что позволяет рекомендовать МАБ в качестве первой линии гормонального лечения данного контингента больных.
РПЖ является одной из наиболее распространенных форм злокачественных опухолей у мужчин. Ежегодно в Европе регистрируется не менее 80 000 новых случаев заболевания. По данным S.L. Parker и соавт.
, 1996 [9], в США РПЖ в настоящее время является самой распространенной опухолью у мужчин, заболеваемость — 317 000 новых случаев в год, смертность — 41 400. В России просматривается явная тенденция к увеличению заболеваемости и смертности от РПЖ. Так, если в 1989 г.
заболеваемость РПЖ составляла 8, 4 на 100 000 населения, то в 1996 г. этот показатель равнялся 11, 3. Показатель смертности в эти годы составлял 6, 5 и 7, 7 на 100 000 населения соответственно. Таким образом, темп прироста заболеваемости в период с 1989 по 1996 г. составил 34,5%, а смертности — 18,5%.
Следует подчеркнуть, что по величине прироста заболеваемости РПЖ стоит на втором месте среди онкологических заболеваний, уступая лишь меланоме кожи и оставляя далеко за собой такие заболевания, как рак желудка (12-е место) и рак легкого (9-е место) (Н.Н. Трапезников, Е.М. Аксель, 1997) [2].
РПЖ чаще всего наблюдается у мужчин старше 50 лет; более 80% всех случаев этого заболевания приходится на мужчин старше 65 лет; средний возраст первичного выявления рака этой локализации составляет 70 — 72 года.В связи с особенностями клинического течения и несовершенством ранней диагностики от 60 до 80% больных РПЖ при первичном обращении имеют метастазы.
| Таблица 1. Методы андрогенной блокады 1. Билатеральная орхидэктомия 2. Эстрогенная терапия 3. «Чистые» антиандрогены 4. Стероидные антиандрогены 5. Агонисты (аналоги) ЛГРГ 6. Орхидэктомия + антиандрогены 7. Антиандрогены + эстрогены 8. Агонисты (аналоги) ЛГРГ + антиандрогены |
В России летальность на 1-м году жизни после установления диагноза составляет 32%, что свидетельствует о крайне низкой выявляемости начальных стадий заболевания (В. В. Двойрин и соавт., 1995) [1].
Выбор методов лечения диссеминированного РПЖ и их последовательность зависят от общего состояния больного и чувствительности опухоли к тому или иному воздействию. Суть лечебных мероприятий состоит в максимальном снижении концентрации эндогенного тестостерона — так называемой андрогенной блокаде.
Возможные методы достижения андрогенной блокады представлены в табл. 1. Начало эры гормонального лечения РПЖ приходится на 40-е годы текущего столетия. После серии известных работ Huggins и Hodges (1939 — 1941 гг.
) [6] долгое время наиболее распространенным методом лечения РПЖ всех стадий являлась эстрогенотерапия и/или билатеральная орхидэктомия. Хороший клинический эффект при лечении РПЖ с помощью кастрации и эстрогенов обусловил широкое распространение этого метода.
Благодаря успехам гормонотерапии другие методы лечения были надолго оттеснены на второй план. Основное место в гормонотерапии отводилось синтетическим аналогам женских половых гормонов — эстрогенам. По данным различных статистик, 5-летняя выживаемость больных РПЖ, леченных эстрогенами, в зависимости от стадии составляет от 18 до 62%.
Однако эстрогенотерапия имеет ряд весьма существенных недостатков, а именно: осложнения со стороны сердечно-сосудистой системы, желудочно-кишечного тракта, свертывающей системы крови, угнетение иммунитета. Больные погибают именно от осложнений, связанных с применением синтетических препаратов эстрогенного действия.
Данные литературы свидетельствуют о высоком проценте летальности при лечении больных РПЖ эстрогенными препаратами. По сводной статистике, от осложнений эстрогенной терапии умирает больных больше, чем непосредственно от РПЖ. Таким образом, данные литературы и наш опыт, основанный на лечении большого числа больных, свидетельствуют о высокой частоте осложнений и неудовлетворительной эффективности рутинной эстрогенной терапии (табл. 2).
Таблица 2. Осложнения (в %) эстрогенотерапии (сводные данные литературы за 1960 — 1995 гг. )Рак предстательной железы — это, как правило, гормонозависимая опухоль, т.е., другими словами, рак простаты чувствителен к андрогенам (мужским половым гормонам). В ткани яичек есть клетки Лейдига, которые вырабатывают 90-95% содержащегося в организме тестостерона (мужского полового гормона). Остальная часть тестостерона вырабатывается в надпочечниках и в жировой ткани.
Один из методов лечения гормонзависимого рака предстательной железы заключается в антиандрогенной терапии (андрогенной блокаде), т.е. в удалении гормонов тем или иным способом.
После антиандрогенной терапии даже у больных с поздней стадией рака простаты в 40% случаев опухоль подвергается обратному развитию, в 40% случаев процесс стабилизируется и только в 20% прогрессирует.
Для достижения хорошего эффекта и удовлетворительных онкологических результатов снижение уровня гормонов должно быть полным, максимальным. Поэтому и антиандрогенная терапия должна носить максимальный характер — отсюда и название — максимальная андрогенная блокада.
Конечной целью максимальной андрогенной блокады является увеличение показателей выживаемости и улучшение качества жизни больных.
Рак простаты (предстательной железы, ПЖ) является гормонально зависимой опухолью. Это значит, что ее рост провоцирует воздействие половых гормонов, в частности тестостерона.
В клетках железы он превращается в другой, более активный андроген — дигидротестостерон (ДГТ), который при возникновении злокачественной трансформации стимулирует активацию онкогенов и, как следствие, бесконтрольное деление и размножение опухолевых клеток. Если это воздействие прекратить, то рост опухоли остановится.
Гормональная терапия не является методом радикального удаления рака, но она может сдерживать его прогрессирование или ремиссию довольно долгое время.
Гормональное лечение оказывает эффект более чем у 90% больных раком предстательной железы (ПЖ), даже в случае диссеминированных форм. Поэтому его можно применять в том числе с паллиативной целью.Но и при курабельных (потенциально излечимых) опухолях, этот метод имеет большое значение в рамках комбинированного воздействия совместно с радикальной операцией или лучевой терапией.
Используются режимы адъювантной и неоадъювантной терапии, в качестве дополнения к хирургической операции или облучению. Кроме того, исследуются альтернативные схемы и режимы, например, интермиттирующая терапия.
Молекулярная основа гормонального лечения рака ПЖ
Чтобы понять, как работает гормональная терапия, давайте разберемся, как функционирует мужская половая система.
Мужские половые гормоны называют андрогенами. Основным из них является тестостерон. Он вырабатывается яичками (тестикулами). На его долю приходится около 95% всех андрогенов в организме мужчины.
Продукцию тестостерона регулирует гипоталамо-гипофизарная система. Гипоталамус вырабатывает рилизинг гормон лютеинизирующего гормона (ЛГРГ), который действует на гипофиз, который, в свою очередь, продуцирует лютеинизирующий гормон (ЛГ).
Именно ЛГ действует на особые клетки в яичках, которые вырабатывают тестостерон.
Оставшиеся 5% андрогенов вырабатывают надпочечники. При этом здесь синтезируется как прямой тестостерон, так и его предшественники — андростендион и дегидроэпиандростерон. Они превращаются в тестостерон уже в тканях простаты.
После попадания в клетки ПЖ, тестостерон превращается в дигидротестостерон (ДГТ) — вещество, по активности превосходящее своего предшественника в 2,5 раза.
Именно он и отвечает за регуляцию внутриклеточных процессов путем присоединения к рецепторам ядра и стимулируя экспрессию генов.
В том числе стимулируются и онкогены, которые приводят к неконтролируемому росту и размножению злокачественных клеток.
Таким образом, яички и надпочечники — это два источника андрогенов в организме мужчин. Раньше гормональная терапия предполагала только подавление выработки тестостерона яичками. Однако в настоящее время имеются данные о том, что андрогены также могут спровоцировать рост опухоли. Поэтому сейчас рекомендовано проводить блокаду по двум направлениям.
Принцип действия андрогенной блокады
Антиандрогенная блокада направлена на предотвращение стимуляции раковых клеток мужскими половыми гормонами. С этой целью могут проводиться следующие мероприятия:
- Хирургическое удаление яичек, которые, как было сказано выше, вырабатывают около 95% всех андрогенов.
- Блокада синтеза андрогенов с помощью медикаментозных препаратов. Блоки могут осуществляться на разных уровнях гипоталамо-гипофизарно-андрогенной системы.
- Блокада циркулирующих андрогенов. В этом случае клетки ПЖ становятся невосприимчивыми к действию половых гормонов, но общий уровень тестостерона в крови остается в нормальных пределах.
Таким образом, применяются следующие виды гормонального лечения:
- Хирургическое удаление яичек — двусторонняя орхэктомия.
- Применение агонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ).
- Терапия антагонистами ЛГРГ.
- Эстрогенотерапия.
- Антиандрогенная терапия.
Стабилизация онкологического процесса и, как следствие, качество жизни пациентов напрямую зависит от того, как долго рак будет реагировать на антигормональную терапию. Дело в том, что злокачественное новообразование — это скопление относительно разнородных клеток.
При раке ПЖ большинство из них изначально имеют зависимость от гормональной стимуляции. При постоянной терапии часть из них погибает или останавливается в росте и размножении. Однако всегда есть минимум 20% гормонально независимых клеток.
Со временем их клон становится преобладающим, и заболевание выходит из-под гормонального контроля — развивается гормональная резистентность.
Диагноз гормонально резистентный рак простаты устанавливается при прогрессировании заболевания на фоне адекватной андрогенной блокады, подтвержденной лабораторно.
Иными словами, опухоль прогрессирует на фоне кастрационного уровня тестостерона (не выше 2 нмоль/л). В настоящее время одним из направлений лечения онкологии простаты является время продления гормональной чувствительности.
С этой целью разрабатываются различные схемы лечения:
- Интермиттирующая андрогенная блокада (ИАБ).
- Минимальная андрогенная блокада.
- Отложенная гормональная терапия.
Двусторонняя орхэктомия (кастрация)
Двусторонняя орхэктомия, или хирургическая кастрация, был самым первым методом гормональной блокады при раке ПЖ. Снижение уровня тестостерона в этом случае достигается уже в течение 12 часов.
Психологически эта операция очень тяжело переносится пациентами, поскольку оказывает необратимый эффект.
Более того, необратимость эффекта неблагоприятно сказывается и при прогрессировании заболевания, поскольку ограничивает резервы воздействия.
Источник: https://ginekologiya-urologiya.ru/potenciya/androgennaya-blokada-raka-predstatelnoj-zhelezy-chto-eto-takoe
Принципы эндокринной терапии рака предстательной железы

Основным мужским половым гормоном является тестостерон. Уровень его регулируется гипоталамо-гипофизарной системой (рис. 9.32). Под влиянием нейро-медиатора норэпинефрина гипоталамус выделяет гонадолиберин, который стимулирует в гипофизе синтез и секрецию
лютеинизирующего гормона (фолликулостимулирующего гормона (
, а также кортиколиберин — стимулятор синтеза и секреции
адренокортикотропного гормона (АКТГ)
Рис. 9.32. Схема нейроэндокринной регуляции секреции андрогенов в мужском организме и их биологические эффекты. Т — тестостерон; X — холестерин
Местнораспространённый и бессимптомный метастатический рак простаты
Тем не менее на фоне длительного наблюдения пациентов, общая продолжительность жизни в зависимости от времени начала гормонального лечения достоверно не изменялась.
Выводы
- Гормональное лечение нельзя применять у мужчин с локализованным раком простаты, поскольку это не приводит к увеличению общей продолжительности жизни, лишь ухудшая показатели смертности за счёт других причин.
- Для пациентов с местнораспространённым, бессимптомным метастатическим и симптоматическим, но не сталированным раком простаты использование немедленного гормонального лечения приводит к значительному увеличению раково-специфической продолжительности жизни, не влияя на общую выживаемость.
- У пациентов с раком простаты со стадией N после РПЭ средняя продолжительность жизни значительно выше при использовании немедленного гормонального лечения, для пациентов без первичного лечения увеличение продолжительности жизни не значимо.
Комбинированное гормональное лечение
Впервые эффективность гормонального лечения (оперативная кастрация и назначение эстрогенов) у пациентов с метастатическим раком простаты показана в 1941 году.
С этого момента гормональная терапия один из основных методов лечения пациентов с распространёнными формами рака простаты. В настоящее время применение гормональной терапии не ограничено группой пациентов с метастатической формой заболевания, использование её в качестве монотерапии или в составе мультимодалыюго лечения обсуждают и для неметастатического рака простаты.
Молекулярные основы гормонального контроля простаты
Рост, функциональная активность и пролиферация клеток простаты возможны при адекватной стимуляции андрогенами. Основной андроген, циркулирующий в крови, тестостерон. Не обладая онкогенными качествами, он необходим для роста опухолевых клеток.
Минимальная андрогенная блокада (периферийная андрогенная блокада)
Предполагает одновременное использование ингибитора 5-а-редуктазы и нестероидного антиандрогенного препарата. Достоинства данной схемы лечения — сохранение качества жизни и сексуальной функции на приемлемом уровне
До получения окончательных результатов клинических исследований использование данной схемы лечения не рекомендовано.
Максимальная андрогенная блокада
- Пациентов обследуют через 3 и 6 мес после начала лечения. Минимальный объём обследования: определение уровня ПСА, пальцевое ректальное исследование и тщательная оценка симптомов, направленная на получение свидетельств эффективности лечения и его побочных эффектов.
- Наблюдение пациента осуществляют на индивидуальной основе с учётом симптомов, прогностических факторов и назначенного лечения.
- Пациентов со стадией заболевания М0 с хорошим ответом на лечение, обследуют (оценка симптомов, пальцевое ректальное исследование, определение ПСА) каждые 6 мес.
- Пациентов со стадией заболевания M1 с хорошим ответом на лечение, обследуют (оценка симптомов, пальцевое ректальное исследование, определение ПСА, общеклинический анализ крови, креатинин, щелочная фосфатаза) каждые 3-6 мес.
- В случаях, когда есть признаки прогрессирования заболевания или при плохом ответе на лечение, необходим индивидуальный подход к наблюдению.
- Рутинное использование инструментальных методов обследования (УЗИ, МРТ, КТ, остеосцинтиграфия) при стабильном состоянии пациента не рекомендуют.
Современная концепция эндокринной терапии РПЖ
Несмотря на то, что РПЖ в 80% случаев обнаруживает высокую чувствительность к гормональным воздействиям, продолжительность и качество жизни больных далеко зашедшим РПЖ практически полностью зависит от того, как долго удается сохранить способность опухоли реагировать на эндокринное лечение.
Эффективность эндокринных воздействий при раке простаты определяется наличием гормональных рецепторов в опухопи. Установлено, что 70% опухолей содержат андрогенрецепторы (AR ), около 10% — рецепторы андрогенов и эстрогенов и 20% — не содержат рецепторов и их метаболизм не контролируется поповыми гормонами.
Если в клеточном составе опухоли преобладают андрогензависимые и андрогеночувствительные клетки (AR ), то результат гормональной терапии будет эффективным, хотя и относительно кратковременным (в среднем 18 мес).
После этого срока закономерно и неминуемо на фоне эндокринной терапии формируется так называемая вторичная гормонорезистентность опухоли.Ее развитие связано с тем, что в процессе опухолевой прогрессии на фоне первичного лечения формируется преобладание андрогеннезависимого субклона клеток, т.к. лечение путем подавления выработки тестостерона обеспечивает селективное преимущество гормоннезависимым клеткам (рис. 9.35).
Рис. 9.35. Схема формирования андрогенной резистентности при прогрессировании РПЖ [Возианов А.Ф. и соавт., 1999].
В результате складывается ситуация, при которой опухоль в основном представлена наиболее агрессивным и наиболее приспособленным к выживанию на фоне гормонального лечения клонов.
Наряду с формирующейся вторичной, существует первичная гормонорезистентность, связанная с тем, что около 20% опухолей изначально нечувствительны к гормонотерапии. Лечение таких опухолей является особенно сложной проблемой.
Ранее считалось, что при проведении эндокринной терапии лучшие результаты достигаются в случаях, когда одновременно оказывается воздействие на все этапы (синтеза, транспорта и метаболизма) функционирования андрогенов путем аблативных, аддитивных и антагонистических антиандрогенных мероприятий.
Для этого была предложена [F. Labrie et al, 1983] комбинированная блокада андрогенов в виде орхиэктомии или химической кастрации с одновременным применением антиандрогенов.
Основной целью такого лечения, по замыслу авторов, было создание максимальной андрогенной блокады (МАБ). Иными словами, МАБ = кастрация (медикаментозная или хирургическая) антиандроген.
D. Prapotnich et al. (2003) уточняли эффективность и длительность интермиттирующей гормонотерапии у 233 пациентов, леченных с помощью различных методик (радикальная простатэктомия, высокоинтенсивный сфокусированный ультразвук). Трехмесячная инъекция аналогов ЛГРГ комбинировалась с нестероидными антиандрогенами.
Лечение прекращалось, когда уровень простатспецифического антигена понижался до 4 нг/мл. Критерием для возвращения к гормонотерапии был ПСА выше 20 нг/мл, прогрессия его за 3 месяца более 5 нг/мл в течение месяца, рецидив болей или мочевых симптомов.
Среднее время выживания составило 42,2 месяца. Авторы делают заключение о возможном обеспечении контроля за опухолью в течение трех лет и отсутствием выраженных осложнений.• пациентам с первичными опухолями больших размеров;• уровнем простатспецифического антигена более 100 нг/мл;• пациентам с выраженными болями;• пациентам с быстро возрастающим уровнем ПСА (
Источник: https://papaprostatit.ru/massazh/androgennaya-blokada-raka-pred/
Что такое андрогенная блокада при раке простаты

Рак предстательной железы — одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. Более 80% заболевших приходится на возраст более 65 лет.
В США рак предстательной железы в настоящее время — это самая распространенная форма злокачественных опухолей у мужчин: в 1996 году выявлено 317 000 новых больных, умерло-41 400.
Вероятность развития микроскопического рака предстательной железы на протяжении жизни составляет 30%,а вероятность летального исхода-3%. В России в последние годы заболеваемость и смертность от рака предстательной железы увеличилась.
Так, если в 1989 году заболеваемость раком предстательной железы составляла 8,4 на 100000 населения, то в 1996 году этот показатель равнялся 11,3. Показатель смертности в эти годы соответственно составлял 6,5 и 7,7 на 100000 населения. Таким образом, темп прироста заболеваемости в период 1989-1996 гг.
составил 34,5% , а смертности — 18,5%. По величине прироста заболеваемости рак предстательной железы стоит на втором месте среди онкологических заболеваний, уступая лишь меланоме кожи, оставляя далеко за собой такие заболевания как рак желудка (12 место) и рак легкого (9 место) (Трапезников Н.Н., Аксель Е.М., 1997).
Современные возможности диагностических методов при раке предстательной железы позволяют выявлять заболевание на ранних стадиях, однако более чем у 60-80% больных на момент диагностики обнаруживают III-IV стадии заболевания. В России летальность на 1 году жизни после установления диагноза составляет 32%(В.В. Двойрин с соавт.,1995).
Основным методом лечения диссеминированных форм рака предстательной железы является эндокринная терапия, начало которой было положено работами Huggins и Hodges (1939-1941 гг.
), предложивших в качестве методов лечения эстрогенотерапию и/или двухсторонюю орхидэктомию с целью максимальноого снижения концентрации эндогенного тестостерона, 90-95% которого вырабатывается в яичках и 5-10% в надпочечниках.
Длительное время основное место в гормонотерапии отводилось синтетическим аналогам женских половых гормонов — эстрогенам. По различным данным 5-летняя выживаемость больных раком предстательной железы, леченных эстрогенами, в зависимости от стадии составляет от 18% до 62%.
Однако эстрогенотерапия имеет ряд очень существенных недостатков, в первую очередь это осложнения со стороны сердечно-сосудистой системы, желудочно-кишечного тракта, свертывающей системы крови, зачастую приводящие к смерти больных.
В настоящее время лечение эстрогенами применяется в качестве второй линии терапии у больных диссеминированным раком предстательной железы. Для повышения эффективности лечения и улучшения «качества жизни» этой группы больных в настоящее время широко используются такие эндокринные препараты как антиандрогены и аналоги рилизинг- гормона лютеинизирующего гормона гипофиза(ЛГРГ), а также их комбинация, получившая название максимальная андрогенная блокада (МАБ).
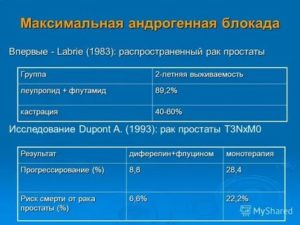
Первые публикации с оценкой результатов применения комбинации антиандрогенов и аналогов ЛГРГ (максимальная андрогенная блокада — МАБ ) были сделаны Labrie F. et al. в 1986 году.
Полученные данные (94% частичных регрессий и 6% стабилизации) вызвали интерес к изучению возможностей МАБ во всем мире.
Работа Labrie была нерандомизированной и выполнена на относительно малом количестве больных, что потребовало проведение рандомизированных исследований.
Были проведены 3 крупных исследования, результаты которых подтвердили преимущества МАБ перед стандартной кастрацией в отношении общей и безрецидивной выживаемости.Это исследование Национального института рака (NCI) (Crawford E. I.
et al, 1989), исследование Европейской организации по изучению и лечению рака (EORTC) (Denis L.J. et al, 1993), и рандомизированное многоцентровое двойное-слепое исследование (Janknegt R. A. et al, 1993).
Крупное плацебо-контролируемое исследование Национального ракового института (NCI) проводило сравнение эффективности МАБ (комбинация ЛГРГ-аналога и флутамида) с хирургической кастрацией в лечении распространенного РПЖ. В результате было показано, что МАБ обеспечивает достоверное удлинение обшей .выживаемости на 7.3 мес., по сравнению с кастрацией (35.6 мес. против 28.3 мес. р=0.039) , а также достоверно удлиняет безрецидивную выживаемость (16.5 против 13.9 мес. , р=0.035).
В рандомизированном исследовании EORTC проводилось сравнение эффективности МАБ (Золадекс + флутамид) с хирургической кастрацией. Результаты исследования продемонстрировали достоверное удлинение выживаемости при применении МАБ (при учете только онкологической летальности) (43.9 против 28.8 мес., р=0.007) а также достоверное удлинение времени до прогрессирования.
Другое большое рандомизированное многоцентровое двойное-слепое исследование (Janknegt R. A. et al, 1993)[7] также демонстрирует преимущества МАБ перед кастрацией. В исследование были включены две группы сравнения.
Больные одной группы получали после кастрации антиандроген нилутамид (анандрон), другие — плацебо. Медиана общей выживаемости была достоверно выше в группе МАБ (37 мес. против 30 мес.). Медиана времени до прогрессирования была так же достоверно выше в группе МАБ (20.8 мес. против 14.9 мес, р=0.05).
Представляет интерес мета-анализ 7 клинических исследований, проведенной группой Bertagna C. et al. 1994[3], которая оценивала сравнительную эффективность МАБ (кастрация + нилутамид) и комбинацию кастрации с плацебо.
Мета-анализ продемонстрировал достоверное преимущество МАБ в плане удлинения общей и безрецидивной выживаемости. Кроме того применение МАБ достоверно увеличивало частоту ремиссии (50% против 33% р
Что такое максимальная андрогенная блокада?
Рак предстательной железы — это, как правило, гормонозависимая опухоль, т.е., другими словами, рак простаты чувствителен к андрогенам (мужским половым гормонам).
В ткани яичек есть клетки Лейдига, которые вырабатывают 90-95% содержащегося в организме тестостерона (мужского полового гормона).
Остальная часть тестостерона вырабатывается в надпочечниках и в жировой ткани.
Один из методов лечения гормонзависимого рака предстательной железы заключается в антиандрогенной терапии (андрогенной блокаде), т.е. в удалении гормонов тем или иным способом.
После антиандрогенной терапии даже у больных с поздней стадией рака простаты в 40% случаев опухоль подвергается обратному развитию, в 40% случаев процесс стабилизируется и только в 20% прогрессирует.
Для достижения хорошего эффекта и удовлетворительных онкологических результатов снижение уровня гормонов должно быть полным, максимальным. Поэтому и антиандрогенная терапия должна носить максимальный характер — отсюда и название — максимальная андрогенная блокада.
Какая конечная цель максимальной андрогенной блокады?
Конечной целью максимальной андрогенной блокады является увеличение показателей выживаемости и улучшение качества жизни больных.
Источники: http://netoncology.ru/press/articles/544/551/, http://03uro.ru/uropedia/prostate-cancer/androgen-deprivation
Источник: https://zdorovnik.com/%D1%87%D1%82%D0%BE-%D1%82%D0%B0%D0%BA%D0%BE%D0%B5-%D0%B0%D0%BD%D0%B4%D1%80%D0%BE%D0%B3%D0%B5%D0%BD%D0%BD%D0%B0%D1%8F-%D0%B1%D0%BB%D0%BE%D0%BA%D0%B0%D0%B4%D0%B0-%D0%BF%D1%80%D0%B8-%D1%80%D0%B0%D0%BA/
Суть и методы гормональной терапии при раке предстательной железы

Рак предстательной железы (РПЖ) – гормонозависимая опухоль. Это означает что она развивается под влиянием мужских половых гормонов – андрогенов (существует даже исследование, доказавшее, что у евнухов рака простаты не бывает).
Следовательно, уменьшив их влияние на злокачественно измененные клетки, можно замедлить рост и даже вызвать регрессию (обратное развитие) новообразования.
Гормональная терапия при раке предстательной железы – один из эффективных методов борьбы с этим онкозаболеванием.
Механизмы регуляции
Чтобы разобраться, почему РПЖ успешно излечивается при использовании гормонотерапии, нужно кратко остановиться на этапах развития этого заболевания.
Рост новообразования активизируется под действием андрогенов – мужских половых гормонов, которые существуют в виде нескольких фракций.
Применительно к раку простаты особенно важны всем известный тестостерон и его измененная под действием ферментов форма под названием дигидротестостерон, который и индуцирует рост и деление клеток предстательной железы. Дигидротестостерон в несколько раз активней своего предшественника.
Когда соотношение между этими фракциями нормальное, мужской организм функционирует без особенностей. Но с возрастом количество свободного тестостерона в крови уменьшается, тогда как уровень дигидротестостерона в тканях остается прежним.
Возникает относительный гормональный дисбаланс, под действием которого клетки простаты начинают активно делиться. Если параллельно под влиянием внешних факторов происходят мутации, активирующие гены, отвечающие за агрессивное деление и рост клетки, возникает раковая опухоль, активность которой продолжают поддерживать мужские половые гормоны.В последние годы появилась теория двойного гормонального эффекта, согласно которой злокачественное перерождение клетки возникает под действием избытка эстрогенов, а андрогены только поддерживают активный рост уже сформировавшейся опухоли.
В организме любого человека есть как мужские, так и женские половые гормоны, для формирования пола принципиально их соотношение.
Сторонники данной теории говорят о том, что у мужчин с РПЖ в крови повышена концентрация андростендиона – вещества, которое с равным успехом может трансформироваться как в тестостерон, так и в эстрон – женский половой гормон.
Такое превращение происходит в жировой ткани (она не просто инертная прослойка – а полноценный эндокринный орган). В пользу теории говорит то, что у пациентов с ожирением риск развития РПЖ в два раза выше, чем у худощавых.
Общие принципы лечения
Гормонотерапия при раке предстательной железы направлена на снижение уровня андрогенов или блокирование рецепторов в тканях, на которые они воздействуют. После того, как на клетки-мишени перестают влиять мужские половые гормоны, внутри клеток активируется процесс естественной гибели (апоптоз).
Варианты
- двусторонняя орхиэктомия;
- препараты-агонисты лютеинизирующего гормона рилизинг-гормона;
- антагонисты лютеинизирующего гормона рилизинг гормона;
- терапия эстрогенами;
- монотерапия антиандрогенами,
- комбинированная андрогенная блокада.
Гормонотерапия при раке простаты как самостоятельный метод лечения на ранних этапах развития новообразования не применяется. Пока карцинома не проросла капсулу предстательной железы, препараты сочетают с радикальной простатэктомией или лучевой терапией. В качестве основной линии они становятся на этапах, когда опухоль распространяется на клетчатку рядом с железой, соседние органы или создает метастазы. Впрочем, и в этой ситуации чаще всего начинают с операции, для того чтобы уменьшить общую массу опухолевой ткани.
Показания
- локализованный РПЖ при невозможности проведения радикального лечения;
- при подготовке к операции или радиотерапии с целью уменьшения объема предстательной железы;
- местнораспространенные опухоли;
- метастатический РПЖ.
Агонисты и антагонисты лютеинизирующего гормона-релизинг гормона (ЛГРГ)
Концентрацию андрогенов в крови регулируют гипоталамус и гипофиз. Сначала гипоталамус синтезирует вещество под названием лютеинизирующего гормона релизинг гормон, который воздействует на клетки гипофиза, высвобождая из них лютеинизирующий и фолликулостимулирующий гормоны, Именно поэтому оно и называется релизинг-гормоном, от английского release – выпускать, высвобождать).
Выделившиеся в кровь лютеинизирующий гормон действует на клетки яичек, ответственных за выработку тестостерона. Из них андроген поступает в кровь, с которой распространяется по тканям, в том числе и в простату, где превращается в дигидротестостерон, который стимулирует рост и деление клеток.
Через несколько минут ЛГРГ разрушается, высвобождая рецепторы гипофиза для следующей порции регулирующего вещества.
Агонисты ЛГРГ
Воздействуют на те же области гипофиза, что и природный гормон. Но в отличие от натурального ЛГРГ, синтетические препараты не разрушаются спустя какое-то время, а надолго блокируют рецепторы. Получается, что сначала под их действием активно выделяется лютеинизирующий гормон, и, следовательно, тестостерон.
Но поскольку рецепторы остаются заблокированными, следующие сигналы организма просто не проходят и после первого резкого скачка уровень андрогенов начинает снижаться, к 21 – 28 дню достигая минимальных значений.
При лечении онкозаболевания первые дозы средств вводят под прикрытием антиандрогенов, чтобы предупредить первоначальный резкий подъем уровня гормонов.
В настоящее время в лечебных целях используют следующие препараты:
- Гозерелин, торговые наименования – Золадекс, гозерелина ацетат;
- Лейпрорелин (Люкрин Депо, Эпигард, Простап);
- Трипторелин (Диферелин, Декаптепил, Декаптепил-депо, Трипторелин-лонг, Трипторелина ацетат);
- Бусерелин (Бусерелин-лонг, Бусерелин-депо, Бусерелин, Супрефакт депо, Супрефакт, Бусерелина ацетат).
Дозировки и кратность введения подбирает врач.
Антагонисты ЛГРГ
Также блокируют рецепторы в гипофизе, но не активируют их. Поэтому не возникает первоначального эффекта «вспышки», и назначения антиандрогенов в дебюте лечения не требуется. Это относительно новый класс медикаментов, используемых для гормонотерапии рака простаты. В него входят:
- Дегареликс (Фирмагон),
- Цетрореликс (Цетротид);
- Ганиреликс (Олгарутран)
- Абареликс (Plenaxis).
В клинических рекомендации по лечению РПЖ указан пока только дегареликс, но при необходимости врач может выбрать и другие препараты этой группы.
Побочные эффекты:
- снижение эректильной функции;
- приливы;
- атрофия мышц;
- остеопороз;
- ожирение;
- гинекомастия (увеличение груди).
Результат действия агонистов и антагонистов ЛГРГ часто называют медикаментозной кастрацией, но в отличие от орхидэктомии, данное состояние обратимо: после окончания действия препаратов уровень половых гормонов постепенно возвращается в норму.
Эстрогены
Уже упомянутый фолликулостимулирующий гормон (ФСГ) активирует синтез не только тестостерона, но и женских половых гормонов, при этом в организме мужчины возможностей для выработки андрогенов в больше, чем для производства эстрогенов.
Концентрацию гормонов в крови по механизму обратной связи регулирует синтез ФСГ: чем больше в крови половых гормонов, тем меньше производится ФСГ. Причем для организма не имеет значения, мужские или женские гормоны циркулируют в крови.
То есть если мужчине ввести эстрогены в значимых количествах, организм сочтет, что половых гормонов у него достаточно и перестанет синтезировать ФСГ – а, значит, нечему будет стимулировать выработку тестостерона, и его концентрация в крови падает.
Из эстрогенных препаратов для терапии РПЖ чаще всего используют диэтилстильбэстрол (торговое наименование Димэстрол).Но эстрогены усиливают тромбообразования и могут привести к опасным для жизни тромбэмболическим осложнениям, поэтому их редко используют как препараты первой линии терапии, назначая только если предыдущее лечения другими группами гормональных средств оказалось безрезультатным.
Побочные эффекты:
- сердечно-сосудистые осложнения;
- тромбоэмболии;
- снижение либидо и нарушения эрекции;
- отеки;
- боль в животе, тошнота, рвота;
- увеличение и болезненность груди;
- нарушение функции печени.
Антиандрогены
Это вещества, которые блокируют действие мужских половых гормонов на клетки простаты и других органов-мишеней. Эти средства делятся на две большие группы – нестероидные и стероидные.
Препараты первой группы нарушают связывание половых гормонов с органами – мишенями, но не влияют на уровень тестостерона в крови.
Стероидные антиандрогены уменьшают и активность синтеза мужских половых гормонов.
Нестероидные:
- Нилутамид (Анандрон),
- Флутамид (Флутакам, Флуцинон, Флутаплекс),
- Бикалутамид (Касодекс, Бикана, Билумид, Калумид, Андроблок).
Побочные эффекты нестероидных андрогенов варьируются в зависимости от конкретного средства.
Стероидные:
- Мегестрол (Мегейс),
- Ципротерон (Андрокур),
- Хлормадинон.
Все стероидные антиандрогены, помимо побочных эффектов, свойственных каждому препарату, имеют и общие нежелательные явления, связанные со снижением уровня тестостерона в организме.
- уменьшение либидо и нарушение эрекции;
- сердечно-сосудистые осложнения;
- желудочно-кишечные расстройства;
- гинекомастия и боль в грудных железах.
Комбинированная андрогенная блокада (КАБ)
Это довольно агрессивный метод лечения, направленный на блокирование не только андрогенов, вырабатываемых яичками, но и половых гормонов, синтезируемых в надпочечниках.
Его используют у пациентов с распространенными формами РПЖ и высокой концентрацией простатспецифического антигена (PSA или ПСА). При КАБ сочетают орхидэктомию или медикаментозную кастрацию с курсом антиандрогенов.
Такая терапия быстрее уменьшает болевой синдром, вызванный метастазами, но не увеличивает продолжительность жизни в сравнении с другими вариантами гормонотерапии.
Эффективность и прогноз
Говорить о выживаемости «в общем» после гормонотерапии довольно сложно. Проблема состоит в том, что в качестве основного метода лечения она используется на относительно далеко зашедших стадиях рака, когда прогноз ухудшается независимо от метода лечения.
Имеет значение и злокачественность самой опухоли (степень дифференцировки по Глисону), уровень ПСА, распространенность метастазов. 5-летняя безрецидивная выживаемость на 1 – 2 стадии при комбинации гормонотерапии с радикальной операцией или лучевого воздействия от 70 до 90%.
При метастатическом же раке вопрос стоит не об излечении, а о продлении жизни. Среднее время до начала прогрессирования процесса составляет 24 – 36 месяцев.
Источник: https://RosOnco.ru/rak-predstatelnoj-zhelezy/gormonoterapiya-rpj
