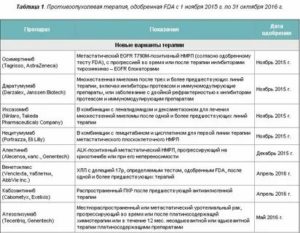
Препараты для таргетной терапии при раке яичников
Рак яичников: метастазы
У пациенток с раком яичников IV стадии (метастатическим раком) заболевание распространилось за пределы брюшной полости или в печень.
В настоящее время стандартным подходом к лечению метастатического рака яичников остается хирургическое вмешательство с последующей химиотерапией. К сожалению, длительная выживаемость после стандартного лечения отмечается менее, чем в 10% случаев.
Дело в том, что рак яичников IV стадии сложно удалить полностью в ходе операции, а доступная в данный момент химиотерапия не способна уничтожить все оставшиеся злокачественные клетки. Пациенткам рекомендуется оптимальная циторедуктивная операция и химиотерапия на основе препаратов платины.
Доказано, что эти методы позволяют отсрочить рецидив и повысить общую выживаемость.
Циторедуктивная хирургия
Во время циторедуктивной операции врачи стараются удалить максимум злокачественных клеток. Циторедуктивное вмешательство способствует уменьшению общего количества раковых клеток и тем самым облегчает задачу для химиотерапевтических препаратов. Такой подход снижает вероятность развития у опухоли резистентности к химиотерапевтическим компонентам.
Первичная циторедуктивная операция считается стандартом лечения рака яичников. По итогам научных исследований можно увидеть, что оптимальная циторедуктивная хирургия повышает выживаемость пациенток и отсрочивает развитие рецидива. Субоптимальное циторедуктивное вмешательство не дает настолько перспективных результатов.
После операции всем пациенткам с раком яичников IV стадии предлагают дополнительное лечение. Дополнительная терапия действительно необходима: многие раковые опухоли яичников рецидивируют даже после полной хирургической резекции.
Что касается метастатического рака яичников, у многих пациенток в организме остаются клетки, которые нельзя удалить традиционным хирургическим способом. Таким больным нужна эффективная терапия, состоящая в уничтожении оставшихся злокачественных клеток.
Дополнительная терапия позволяет улучшить достигнутые результаты. В настоящее время таким способом лечения является химиотерапия.
Химиотерапия при метастатическом раке яичников
Результаты клинических испытаний демонстрируют, что применение комбинированной химиотерапии с содержанием препарата на основе платины (Платинол или Параплатин) продлевает выживаемость женщин, больных метастатическим раком яичников.
Кроме того, такие схемы более эффективны в профилактике рецидивов рака, чем комбинации хирургического вмешательства с химиотерапией без препаратов платины.
Традиционная схема химиотерапии состоит из паклитаксела и препарата платины, которые следует принимать один раз в три недели на протяжении 6-8 циклов.
Чаще всего врачи назначают химиотерапию после того, как пациентка перенесет операцию. В некоторых случаях химиотерапия применяется не только после, но и до операции.
Предоперационное лечение противораковыми медикаментами уменьшает объем злокачественных тканей, то есть – облегчает удаление максимального количества раковых клеток в ходе хирургического вмешательства.Этот подход к лечению до сих пор вызывает вопросы у многих специалистов, однако в ряде случаев он показан избранным пациенткам с метастатическим раком яичников, которым по какой-либо причине нежелательно сразу ложиться на операцию.
К сожалению, 5-летняя выживаемость без признаков рецидива наблюдается менее, чем в 10% случаев, – даже несмотря на лечение паклитакселом и препаратом на основе платины.
Так как у многих пациенток рак рецидивирует даже после стандартной терапии, врачам и больным следует задуматься об участии в клинических испытаниях.
Во многих научных исследованиях изучаются инновационные методы первичной терапии метастатического рака.
Стратегии совершенствования лечения
Прогресс в лечении рака яичников стал достижимым благодаря совершенствованию методик лечения и тестированию новых стратегий и медикаментов в рамках клинических испытаний. В настоящее время ученые активно изучают несколько новых методик лечения этого заболевания.
- Препараты таргетной терапии
Препараты таргетной терапии – это противораковые медикаменты, которые нарушают особые сигнальные пути, участвующие в процессе роста и обеспечении выживаемости раковых клеток. Прием этих медикаментов можно сочетать с другими способами лечения рака, включая традиционную химиотерапию.
Ученые возлагают определенные надежды на новый таргетный препарат для лечения рака яичников – Авастин (бевацизумаб).
Авастин замедляет или предотвращает рост новых кровеносных сосудов, ингибируя белок под названием VEGF. Тем самым он лишает раковые клетки кислорода и питательных веществ.Воздействуя на сосуды, препарат облегчает поступление химиотерапевтических средств к раковой опухоли.
Уточнить цену у специалиста
Консолидирующая, или поддерживающая, терапия – это дополнительная химиотерапия, назначаемая по завершении стандартного курса.
В настоящее время проводятся клинические исследования, в ходе которых ученые пытаются более подробно изучить особенности данной методики.
Основной вопрос звучит следующим образом: повышает ли такая терапия выживаемость пациенток с метастатическим раком яичников – и если да, стоит ли ради этого подвергать больных потенциальным рискам, связанным с побочными эффектами в результате продолжительного лечения?
- Интраперитонеальная химиотерапия
Данная методика позволяет уничтожить множество раковых клеток за счет обработки всей брюшной полости химиотерапевтическими препаратами.
Лекарства поступают через большой катетер, устанавливаемый внутрь брюшной полости во время операции по удалению опухоли.
Наибольшая эффективность интраперитонеальной химиотерапии наблюдается после хирургического удаления всех островков раковых тканей, превышающих размером 1 см. (Такое хирургическое вмешательство называется оптимальной циторедукцией.)
В ходе клинического испытания третьей фазы ученые сравнили эффективность 2 подходов к лечению женщин с раком яичников III стадии, перенесших оптимальную циторедукцию:
- одна группа пациенток лечилась только химиотерапевтическими препаратами для внутривенного введения;
- в стратегию лечения второй группы женщин добавили интраперитонеальную химиотерапию.
Показатели выживаемости пациенток второй группы превзошли аналогичные показатели больных первой группы более, чем на 1 год, но при этом дополнительная интраперитонеальная химиотерапия привела к усугублению побочных эффектов.
- Химиотерапия с сокращенными интервалами
Применение нескольких разных однокомпонентных режимов химиотерапии с сокращенными интервалами и максимально возможными дозировками повышает действенность лечения и в некоторых случаях предотвращает развитие лекарственной устойчивости у раковых клеток.
Так как «уплотненная» химиотерапия способна привести к тяжелым побочным эффектам, следование оптимальному графику приема медикаментов нередко снижает риск развития побочных эффектов, характерных для комбинированной терапии, и позволяет при этом сохранить мощное противораковое действие препаратов.
Недавно ученые провели клиническое испытание с целью оценки режима химиотерапии, состоящего в применении 3 лекарств с сокращенными интервалами и показанного пациенткам с метастатическим раком яичников.
Схема состояла из четырех курсов Платинола и Гикамтина с последующими четырьмя курсами Платинола и паклитаксела. (Пациентки перенесли хирургическую операцию либо до химиотерапии, либо между курсами.) На основе полученных данных ученые зафиксировали полное или частичное исчезновение признаков рака почти у 80% участниц исследования.
- Высокодозная химиотерапия и аутологичная трансплантация стволовых клеток
Химиотерапия атакует и уничтожает быстро делящиеся клетки – в том числе раковые. Высокодозная химиотерапия убивает больше злокачественных клеток, чем традиционная химиотерапия с низкими дозами.
К сожалению, высокодозная химиотерапия также уничтожает больше здоровых клеток, в особенности кроветворящих стволовых клеток в костном мозге.
Стволовые клетки – это незрелые клетки, вырабатываемые костным мозгом – губчатым веществом внутри костей.
Стволовые клетки рано или поздно превращаются либо в эритроциты, доставляющие кислород к тканям, либо в лейкоциты, борющиеся с инфекциями, либо в тромбоциты, способствующие свертыванию крови.
Высокодозная химиотерапия уничтожает и раковые, и здоровые стволовые клетки. Разрушение костного мозга приводит к уменьшению запасов стволовых клеток, а следовательно – и к снижению уровней циркулирующих кровяных телец. Когда уровни циркулирующих кровяных телец становятся критическими, развиваются осложнения:
- анемия
- инфекции
- кровоизлияния
Так как все эти осложнения могут привести к летальному исходу, необходимо как можно скорее восстановить уровни кровяных телец. Именно поэтому большинству пациенток, перенесших высокодозную химиотерапию, назначают трансплантацию стволовых клеток.
Аутологичная трансплантация стволовых клеток подразумевает забор и замораживание собственных стволовых клеток пациентки до начала химиотерапии. По завершении лечения эти клетки вводят обратно в организм пациентки для «спасения» костного мозга.
Исследователи, ведущие Регистр аутологичных трансплантатов крови и костного мозга, оценили результаты лечения более 400 женщин с метастатическим раком яичников, перенесших высокодозную химиотерапию и аутологичную трансплантацию стволовых клеток. Спустя 2 года после лечения в живых остались 35% участниц данного исследования.
Более того: ученые выделили подгруппу, в рамках которой двухлетняя выживаемость составила 55%. В эту подгруппу вошли более молодые женщины с раком определенного микроскопического типа (несветлоклеточным), не страдающие иными заболеваниями. Они перенесли высокодозную химиотерапию и аутологичную трансплантацию стволовых клеток во время первой ремиссии.
Результаты исследования указывают на потенциальное повышение показателей выживаемости благодаря высокодозной химиотерапии и аутологичной трансплантации стволовых клеток. Эта стратегия особенно эффективна при условии ее применения на начальных этапах курса лечения.
Комбинирование двух и более стратегий лечения – это наиболее перспективное направление научной работы. Так, пациентка получает наибольший шанс на полную ремиссию, если курс ее лечения состоит из следующих процедур:
- индукционной химиотерапии с сокращенными интервалами,
- интервальной циторедукции и высокодозной химиотерапии,
- аутологичной трансплантации стволовых клеток.
Пациенткам, достигшим ремиссии, показано дополнительное лечение в виде поддерживающей химиотерапии или применения средств биологической терапии. Многие комбинированные подходы в настоящее время тестируются в клинических испытаниях.
Выбирая метод лечения, нужно задать врачу следующие вопросы:
- Доказано ли, что инновационная методика лучше традиционного подхода? Так как рецидив наблюдается более, чем у 50% пациенток с раком яичников IV стадии, не стоит сравнивать такие показатели, как ответная реакция на химиотерапию, средняя выживаемость или выживаемость без рецидивов.
- Если вы выбираете стратегию лечения, лучше сравнить число (процент) пациенток, проживших 3-5 лет после лечения – с рецидивами или без таковых. Это наилучший показатель эффективности того или иного подхода.
- Что известно о рисках или побочных эффектах нового метода? Важно понимать, что чем больше вы лечитесь, тем сильнее становятся побочные эффекты.
Так как первичная терапия практически не помогает пациенткам с метастатическим раком яичников, не стоит надолго откладывать принятие решения о лечении новыми методами. В противном случае повышается риск тяжелых побочных эффектов при меньшей действенности терапии.
В сентябре 2015 года я почувствовала комок в левой груди. Я не паникер, но я знала, что это может значить. У меня была назначена встреча через месяц с моим акушером-гинекологом, поэтому сначала я подумала, что подожду и поговорю об этом со своим врачом.
У меня была маммография всего шесть месяцев назад. Но после изучения информации в интернете, я поняла, что для безопасности нужно встретиться с врачом раньше.
Читать далее…
Источник: https://Oncocenter-Ichilov.com/lechenie-raka-yaichnikov-v-izraile/metastazy-pri-rake-yaichnikov/
Рак яичников – современные методы лечения

Рак яичника требует четкой гистологической диагностики и дифференцированного лечебного подхода. В зависимости от характеристик опухоли, онкологи и гинекологи проводят щадящие лапароскопические и открытые операции, фотодинамическую и лучевую терапию.
Помимо классической химиотерапии и антиэстрогенных препаратов, в клиническую практику вошли препараты для таргетной терапии злокачественных новообразований яичников.
Также изучаются методики адресной доставки химиотерапевтических препаратов к опухоли при помощи наночастиц.
Местная терапия при раке яичников
Местная терапия включает хирургическое удаление опухоли, фотодинамическую терапию и облучение пораженных метастазами органов.
Особенность местной терапии – это прицельное разрушение первичной опухоли или метастазов с минимальным воздействием на здоровые ткани.
Схема лечения включает одну или несколько терапевтических методик и разрабатывается по результатам диагностики. При подозрении на рак яичников диагностика включает:
- Анализ крови на онкомаркеры СА 125, СА 19-9, HE 4, СА 72-4
- Анализ крови на АФП и β-ХГЧ при подозрении на герминогенные опухоли
- Анализ крови на ингибин при подозрении на стромальные опухоли
- УЗИ органов брюшной полости и малого таза
- КТ органов грудной клетки, брюшной полости и малого таза с контрастированием
- Биопсия с гистологическим исследованием
Хирургическое лечение проводится в тех случаях, когда опухоль можно удалить полностью, либо когда операция существенно облегчит состояние пациента (устранит болевой синдром, восстановит нормальную работу кишечника и т.п.). При раке яичников проводятся такие виды операций:
- Одностороннее удаление яичника. При поражении фаллопиевой трубы она также удаляется в ходе лапароскопической сальпингоовариоэктомии.
- Двустороннее удаление яичников.
- Сочетанное удаление яичников и матки.
- Операции при распространенном раке.
Фотодинамическая терапия проводится во время хирургического вмешательства или в послеоперационном периоде. До начала процедуры женщина принимает препарат на основе фталоцианина.
Фталоцианин – это пигмент, который накапливается в злокачественных клетках и под воздействием инфракрасного излучения распадается с образованием активных форм кислорода. Кислородные радикалы окисляют внутренние структуры раковых клеток и разрушают опухоль.
Для здоровых тканей фотодинамическая терапия полностью безопасна и нетоксична.
Лучевая терапия редко используется в качестве основного вида лечения первичной опухоли, но эффективна при локальных и отдаленных метастазах.
В частности, лучевая терапия становится методикой выбора при неоперабельных метастазах в головном или спинном мозге.
В зависимости от локализации злокачественного очага, онкологи и клинические радиологи используют прицельную внешнюю лучевую терапию или внутреннее облучение – брахитерапию.
Системная терапия при раке яичников
Системная терапия подразумевает внутривенное или пероральное введение лекарственных препаратов, которые поступают в системный кровоток и достигают первичной опухоли и ее метастазов. Системное лечение эффективно на поздних стадиях онкологии, когда невозможно удалить первичную опухоль полностью, а микрометастазы присутствуют в матке, маточных трубах, сальнике, селезенке или печени.
Химиотерапия рака яичников проводится в комбинированном режиме с применением цитостатических препаратов платины (например, цисплатина или карбоплатина) и таксанов (например, паклитаксела и доцетаксела). Препараты вводятся внутривенно, каждые 3-4 недели. В большинстве случаев курс химиотерапии включает от 3 до 6 таких циклов.
Гормональная терапия наиболее эффективна при стромальных опухолях. Она включает три группы препаратов, которые блокируют действие эстрогенов:
- Агонисты рилизинг-фактора лютеинизирующего гормона, напрямую подавляющие синтез эстрогенов в яичниках
- Тамоксифен, обладающий антиэстрогенной активностью
- Ингибиторы ароматазы, подавляющие синтез эстрогенов из других стероидных гормонов
Таргетная терапия на сегодняшний день включает 2 типа препаратов:
- Ингибиторы ангиогенеза, которые подавляют факторы роста эндотелия сосудов и способствуют уменьшению опухоли в размерах.
- Ингибиторы поли(АДФ-рибоза)-полимеразы (PARP), которые лишают опухолевые клетки способности восстанавливать поврежденную ДНК, что в конечном итоге ведет к их гибели. Ингибитор PARP олапариб (Линпарза) вошел в клиническую практику досрочно, благодаря процедуре ускоренного одобрения, которую FDA проводит в исключительных случаях.
Дополнительные методы лечения и последующее наблюдение
Дополнительные методы применяются в рамках комплексного терапевтического подхода, наряду с классическими медицинскими вмешательствами. Их цель – усилить действие основной терапии и смягчить ее побочные эффекты, снять стресс и улучшить качество жизни пациента. К таким методам относятся:
- Иглоукалывание
- Массажные практики
- Фитотерапия
- Ароматерапия
- Медитация
- Йога и гимнастика цигун
После завершения активного лечения и выписки из клиники, женщина остается под наблюдением гинеколога и онколога. В перечень обязательных обследований входят гинекологический осмотр, анализ крови на СА 125 и УЗИ органов брюшной полости. Они проводятся каждые 3 месяца в течение первых двух лет, каждые 4 месяца в течение третьего года и каждые 6 месяцев в последующие годы.
При появлении жалоб, патологических изменений на УЗИ или повышении уровня СА 125 проводится расширенное обследование – КТ органов брюшной полости и малого таза, а также рентгенография или КТ органов грудной клетки. При своевременном начале лечения с применением современных хирургических технологий и фармацевтических препаратов уровень пятилетней выживаемости на первой стадии рака яичников достигает 90%.
Лечение опухолей яичников за рубежом с Booking Health
Booking Health – интернет-портал, на котором пациенты могут изучить информацию о медицинских учреждениях и актуальных методиках лечения, а также забронировать медицинскую программу в ведущих клиниках мира. Booking Health работает в соответствии с требованиями международной сертификации ISO 9001:2015 в сфере медицинского туризма, что позволяет предложить пациентам эффективную терапию в кратчайшие сроки.
Специалисты Booking Health помогают в таких важных моментах:
- Выбор клиники, специализирующейся на онкологии и гинекологии
- Прямая коммуникация с лечащим врачом
- Предварительная подготовка медицинской программы с учетом актуальных симптомов и без обязательного повторения проведенных ранее обследований
- Контроль стоимости медицинских услуг, исключение надбавок и коэффициентов для иностранцев (общая экономия до 50%)
- Запись на прием на желаемую дату
- Контроль выполнения всех этапов медицинской программы
- Cтраховка от повышения стоимости лечения в случае развития осложнений (покрытие 200 000 евро, срок действия – 4 года)
- Помощь в приобретении и пересылке медикаментов
- Поддержание связи с клиникой после завершения лечения, организация дополнительных обследований и дистанционных консультаций
- Контроль счетов и возврат неизрасходованных средств
- Услуги переводчика и медицинского координатора
- Сервис высочайшего уровня: бронирование жилья, билетов, трансфера
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Доктор Надежда Иванисова
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Booking Health – Стандарты качества
Источник: https://bookinghealth.ru/blog/lechenie/diagnostika-i-lechenie/599294-rak-yaichnikov-sovremennye-metody-lecheniya.html
Лечение рака яичников у женщин на 1-4 стадии, что делать, таргетные препараты
Рак яичника у женщин – это онкологическое заболевание, требующее незамедлительного лечения.
В большинстве случаев назначается комплексная терапия, выбор которой основывается на результатах диагностического обследования больной.
При выборе тактики проведения терапевтических мероприятий необходимо основное внимание обращать на степень течения и распространенность злокачественного новообразования, возраст и общее состояние пациентки.
В современной медицине применяется одновременно несколько методов, при помощи которых лечится раковая опухоль яичника.
Хирургическое вмешательство является одной из наиболее востребованных методик в лечении рака вне зависимости от стадии онкозаболевания.
Основная задача операции заключается в том, чтобы максимально полно удалить злокачественную опухоль. Чаще всего используется радикальное удаление. Как правило, это гистерэтомия с иссечением придатков.
На поверхности полости брюшины делают разрез. Через него осуществляется удаление пораженных яичников, маточного тела, большого сальника и фаллопиевых труб. Применение таких мер позволяет максимально снизить вероятность повторного формирования новообразования.Если онкологический процесс диагностируется в начале своего развития, а женщина желает сохранить репродуктивную функцию, то специалисты принимают решение, если это возможно, о проведении оперативного вмешательства с сохранением здорового яичника. Однако необходимо помнить, что подобная тактика повышает риски рецидивов болезни.
В случае когда опухоль выявляется на второй и более поздних стадиях в ходе операции удалению подвергаются яичники, придатки, матка и большой сальник. Благодаря таким мерам удается продлить сроки жизни больной и предотвратить распространение метастазов.
В ходе оперативного вмешательства в обязательном порядке проводят биопсию. Это процедура, позволяющая сделать забор патологического биоматериала для дальнейшего его исследования с целью установления характера опухоли.
При лечении рака яичников 3 стадии, когда отсутствует процесс метастазирования, также возможно проведение лимфаденэктомии, когда, кроме пораженного органа, иссекается часть забрюшинных лимфатических узлов.
Если опухоль является неоперабельной, что бывает при 4 стадии онкологического заболевания, когда метастазы начинают распространяться на рядом расположенные анатомические структуры, то выбирается другая тактика лечения.
Это процедура, метод которой заключается в применении противоопухолевых препаратов, действие которых направлено на подавление роста и дальнейшего распространения раковых клеток.
В большинстве случаев химиотерапию используют в качестве вспомогательного лечения после хирургического вмешательства или если операция по каким-либо причинам не может быть проведена.
Химиотерапевтическое лечение может быть двух видов.
Неадьювантная
Проводят перед удалением злокачественного образования. цель – уменьшить объемы опухоли, что позволит получить наиболее максимальный эффект от хирургического вмешательства. Проводят химиотерапию маленькими курсами.
Адьювантная
Назначается после операции. Длительность лечения во многом будет зависеть от стадии онкопроцесса и типа рака. Другими словами, чем выше риск повторного развития болезни, тем агрессивнее схема терапевтического лечения.
Химиотерапия может проводиться одним или одновременно несколькими препаратами. Наиболее распространенными являются такие противоопухолевые средства, как Циспатин, Адриабластин, Циклофосфан, Винкристин, Актиномицин Д, Винбластин, Ифосфамид, Паклитаксел, Этопозид.
Данные препараты могут использоваться в различной комбинации. Наиболее распространенной при лечении рака яичников считается схема САР (Циклофосфан+Цисплатин+Адриабластин).
Доза и длительность приема химиопрепаратов рассчитывается в каждом случае индивидуально. Среди препаратов первой линии выделяют Карбоплатин и Паклитаксел. Их в большинстве случаев сочетают с Гемацитабином, Фторурацилом, Доцетакселом и другими.В зависимости от того, на какой стадии развития находится злокачественная опухоль, специалист может назначить от трех до шести курсов химиотерапии. Перерыв между ними составляет несколько недель.
Основной принцип данного вида терапевтического вмешательства заключается в том, чтобы воздействовать на очаг поражения посредством радиоактивного излучения. Лучи разрушают раковые клеточные структуры, тем самым приостанавливая дальнейший рост опухолевого образования. Стоит также отметить, что такой метод оказывает минимальное негативное воздействие на здоровые ткани.
В большинстве случае данная методика применяется при рецидивах или в качестве паллиативной терапии для уменьшения выраженности болевого синдрома и остановке прогрессирования онкопроцесса.
Проводится лучевая терапия только в условиях стационара. Требуется, как правило, 1-10 сеансов. Продолжительность каждого из них определяется врачом-онкологом.
Когда лучевая терапия используется после операции, то основная ее задача сводится к тому, чтобы уничтожить остаточные атипичные клетки.
В современной медицине в последнее время при лечении рака яичников все чаще стали использовать таргетные препараты. Они также как и противоопухолевые средства негативно воздействуют на раковые клеточные структуры, но при этом здоровые ткани не затрагиваются.
Широкое распространение получило такое медикаментозное средство, как Авастин. Он способствует перекрытию кровоснабжения опухоли, в результате чего она перестает расти. Кроме того, применение данного препарата способствует уменьшению рисков распространения метастазов.
Также нередко назначается Бевацизумаб и Олапариб.
Часто отмечаются такие случаи, когда опухоль растет под влиянием какого-либо гормона. Чтобы снизить его выработку в организме, назначают гормональную терапию. Для выполнения поставленной задачи применяются прогестины, андрогены, эстрогены и антиэстрогены.
Можно ли избавиться от болезни
Полностью вылечить рак яичника можно только при его выявлении на начальной стадии развития. Если заболевание протекает в более поздней форме, то лечение сводится поддержанию жизни пациентки и улучшению ее качества.
Рак яичников характеризуется формированием злокачественного новообразования. Чем раньше будет обнаружена болезнь, тем больше шансов на полное излечение. Заболевание нельзя оставлять без внимания, поскольку оно может быстро прогрессировать.
Источник: https://onkologia.ru/onkoginekologiya/lechenie-raka-yaichnikov/
Таргетная терапия: 10 эффективных лекартвенных препаратов
Таргетная терапия (название своё получила от английского «target» – «цель») — один из видов лечения злокачественных опухолей, получивший особенно мощное развитие в первых десятилетиях 21-го века.
Большинство таргетных препаратов не обладают способностью убивать раковые клетки, они только замедляют их рост. Полного излечения они не дают.
Как действует таргетная терапия?
В отличие от цитостатиков, таргетные препараты не убивают раковые клетки, а замедляют интенсивность их деления или повышают степень их дифференцировки. Ведь известно, что чем моложе клетки опухоли, тем они «злее»: интенсивно пролиферируют, быстро растут и мигрируют во все органы и ткани организма.
Концепция «мишени» была сформулирована в середине прошлого века Паулем Эрлихом, немецким иммунологом, химиком и одним из основоположников химиотерапии. На примере микроорганизмов, мишень — это специфический фермент патогенного микроорганизма, необходимый для его жизнедеятельности, но отсутствующий в клетках хозяина.
От таргетных препаратов в онкологии хотелось бы ожидать того же: чтобы препарат воздействовал только на опухолевую клетку, не повреждая при этом здоровые клетки макроорганизма.
Но, к сожалению, отличие между трансформированными и здоровыми клетками оказалось не таким большим, как отличие между клетками человека и бактерии, и развитие таргетной терапии злокачественных новообразований приостановилось.
Успехи молекулярной онкологии в конце прошлого века вернули к жизни идею о «мишенях» в случае лечения новообразований. Мишенями стали собственные белки организма, участвующие в процессах канцерогенеза (канцерогенез — сложный процесс развития опухоли) и повышающие способность опухоли к прогрессии и метастазированию.Мишенями могут быть киназы (молекулы, катализирующие перенос фосфатных групп с энергетических молекул АТФ на иной субстрат), факторы ангиогенеза, рецепторы к тканеспецифичным гормонам, нестабильные участки генома.
Показания к применению таргетной терапии
Показаниями к применению являются:
- остановка роста злокачественного новообразования, переход заболевания в хроническую стадию. Рост новообразования замедляется, и пациент может прожить ещё несколько лет или десятки лет без снижения качества жизни;
- тяжёлое состояние пациента, делающее невозможным применение стандартных схем лечения с помощью химиопрепаратов и лучевой терапии;
- снижение агрессивности лучевой терапии и химиотерапии при комбинированном лечении. Применение таргетных препаратов при некоторых локализациях злокачественных новообразований позволяет уменьшить лучевую нагрузку на пациента.
Таргетная терапия в онкологии: препараты
Основные цели, на которые направлены таргетные препараты:
- рецепторы к эпидермальному фактору роста;
- рецепторы к фактору роста сосудов;
- сигнальные белки клеток;
- молекулы, регулирующие апоптоз (прим.: апоптоз — генетически запрограммированная гибель клетки «от старости»);
- гены, отвечающие за рост и развитие раковых клеток;
- выключение ряда генов опухолевой клетки.
Также все препараты можно разделить на две большие группы: малые молекулы и антитела.
Антитела, в силу своего большого молекулярного веса, не могут проникнуть через мембрану опухолевой клетки, поэтому они взаимодействуют в основном с рецепторами на мембранах.
Малые молекулы, за счёт своего маленького веса, могут проникать внутрь клетки и обладают широким спектром мишеней. Также они способны проникать через гематоэнцефаличекий барьер, в нервную ткань, что даёт возможность лечить метастазы в ней.
Ингибиторы тирозинкиназы (малые молекулы)
Тирозинкиназы – специфические ферменты, одни из главных звеньев в цепи передачи внутриклеточного сигнала. Они бывают двух видов: рецепторные и внутриклеточные. Рецепторные имеют часть, которая находится на мембране клетки, внутриклеточные – нет.
К ингибиторам относятся, например, Акситиниб (злокачественные новообразования почки), Гефитиниб (местнораспространённый немелкоклеточный рак лёгкого), Иматиниб (хронический миелоидный лейкоз), Тарметиниб (злокачественная меланома кожи) и т.д.
Так как тирозинкиназы работают не только в опухолевых, но и в нормальных клетках – препараты не лишены токсических побочных эффектов.
Комплексные препараты малых молекул
Ярким примером является Винтафолид – низкомолекулярный конъюгат, тропный к рецепторам фолиевой кислоты.
Фолаты необходимы для процессов транскрипции ДНК. Так как в опухолевой клетке деление ДНК проходит активно, она экспрессирует (синтезирует и выводит из цитоплазмы на поверхность) на своей мембране много рецепторов к фолатам, чтобы захватить как можно больше вещества.
Винтафолид связывается с рецептором к фолиевой кислоте, захватывается клеткой путём эндоцитоза (прим.
: эндоцитоз — процесс захвата клеткой молекул из внешней среды с помощью пузырьков — везикул) и дальше начинает действовать уже внутри клетки, останавливая её рост и вызывая апоптоз.
Целью молекулы являются быстрорастущие клетки рака яичника, немелкоклеточного рака лёгкого, молочной железы, толстого кишечника и почек.
На данном этапе проводятся клинические испытания при лечении рака яичников у женщин, результаты которых успешны.
- примером таких киназ служат киназа BRAF, которая является участником сигнального пути Ras-Raf-MAPK, контролирующего клеточную пролиферацию, дифференцировку и апоптоз. В злокачественных опухолях часто обнаруживаются мутации гена BRAF-киназ, например, в случае метастатического колоректального рака, меланомы или папиллярного рака щитовидной железы.
Примером препарата может быть Вемурафениб, вызывающий апоптоз клеток меланомы. Он активен только против клеток, линия которых имеет мутацию в опредёленном гене.
Но, к сожалению, клетки злокачественных новообразований могут приспосабливаться и мутировать, формируя обходные пути для получения энергии, выживания и роста опухоли.
Моноклональные антитела
Препараты моноклональных антител чаще всего получены рекомбинантным способом и представляют собой антитела, вырабатываемые клонами одной плазматической клетки. Препараты, например, Ритуксимаб (используется в лечении неходжскинской лимфомы), Ипилимумаб (лечение меланомы), Трастузумаб (рак молочной железы) успешно применяются в клинической практике.
Анти-HER2-терапия
Протеинкиназа, относящаяся к семейству белков эпидермального фактора роста. Все белки семейства состоят из трёх частей – внеклеточной, внутримембранной и внутриклеточной. Мишенью таргетных препаратов является внеклеточная его часть.
Повышается экспрессия этого белка на клетках рака молочной железы. Также этот белок могут производить в большом количестве клетки рака яичников, желудка, матки.
Взаимодействие молекулы с этим рецептором запускает каскад внутриклеточных реакций, дающий клетке энергию для синтеза своего белка и размножения.
Герцептин или Трастузумаб, представляет собой порошок для приготовления растворов, содержащий рекомбинантные антитела, которые взаимодействуют с внеклеточной частью рецептора HER2. Опухолевые клетки производят слишком много таких рецепторов, Герцептин направлен на их блокирование и торможение роста злокачественных клеток. Используется при лечении рака молочной железы.
Пертузумаб
Это также моноклональные антитела, блокирующие рецептор HER2. Он действует немного по-другому – блокирует передачу внутриклеточного сигнала к росту клетки.
Опухолевая клетка не получает энергии и питательных веществ, останавливается в росте и развитии и подвергается разрушению.
Показанием к применению является также рак молочной железы, экспрессирующий HER2 в большом количестве, не поддающийся другим способам лечения.
Трастузумаб эмтазин – международное непатентованное название препарата. Его молекула состоит из двух частей: одна – трастузумаб – описана выше. Другая – производное ингибитора полимеризации тубулина DM1, вызывает остановку деления опухолевой клетки и её гибель.
Этот препарат за счёт своего сложного строения более специфичен (прим.: специфичность — свойство белковых молекул или иных веществ взаимодействовать только друг с другом). Компонент DM1 работает только в тех клетках, с которыми связался Трастузумаб, то есть, в клетках опухоли.
Здоровые клетки в гораздо меньшей степени подвергаются цитостатическому эффекту.
Антиангиогенная таргетная терапия
Опухолевые клетки активно делятся, следовательно, требуют много питательных веществ и кислорода, которые они могут получить только из крови. Для этого опухоль заставляет организм активно снабжать её кровью, и опухолевая ткань обильно прорастает сосудами.
Одним из препаратов является Бевацизумаб. Он подавляет фактор роста эндотелия сосудов. Применяется при метастатическом колоректальном раке, раке молочной железы.
Анти-PARP-препараты
ИНТЕРЕСНО: PARP -1 — фермент, участвующий в исправлении поломанной ДНК клеток. Действие цитостатических химиопрепаратов основано на повреждении ДНК опухолевых клеток и остановке их деления. Анти- PARP препараты способствуют процессу гибели опухолевых клеток, выключая их способность исправлять поломки ДНК и вызывая их гибель.
Побочные эффекты таргетной терапии
Ещё не изобретено лекарство, которое не имело бы побочных эффектов. Таргетные препараты используются для лечения сложных заболеваний, применяются длительно, оказывают влияние и на здоровые клетки, поэтому список побочных эффектов довольно длинный.
В этом списке будут на первом месте сердечно-сосудистые осложнения. Среди них лидирует артериальная гипертензия. Возникновение данного осложнения связано, чаще всего, с применением ингибиторов VEGF.
Патогенез тромботических осложнений связан с нарушением взаимодействия эндотелиальных клеток с тромбоцитами и их апоптозом на фоне блокирования VEGF.
Кардиотоксичность является основным побочным эффектом для Трастузумаба, на фоне приёма препарата у пациентов возникает сердечная недостаточность.
Таргетные препараты оказывают влияние на дыхательную систему, на фоне приёма препаратов может возникать интерстициальный пневмонит, затем лёгочной фиброз. Большое значение в развитии данного осложнения имеет наличие хронических заболеваний дыхательных путей и курение.
Некоторые таргетные препараты нефротоксичны, клинически это проявляется бессимптомной протеинурией, острой почечной недостаточностью и нефротическим синдромом.
Также побочным эффектом является гепатотоксичность и реакции со стороны ЖКТ. Например, диарея связана с нарушением обмена ионов натрия, калия, хлора между клетками кишечника и внешней средой. Частым побочным эффектом является тошнота и рвота, что требует назначения противорвотных средств. Потеря аппетита, изменения вкуса также могут доставлять пациенту неприятные ощущения.
Кожная токсичность проявляется фоточувствительностью, появлением угревидной сыпи, гиперкератозами, эритемой, в тяжёлых случаях – буллёзным дерматитом.Побочные эффекты обусловлены действием химиопрепаратов на нормальные клетки организма и по большей части они обратимы. Главное – вовремя их диагностировать и начать симптоматическое лечение, чтобы избежать многих проблем.
Преимущества:
- возможность проходить лечение амбулаторно;
- большинство препаратов выпускаются в форме таблеток, что облегчает пациентам их применение;
- позволяет снизить дозы гормональной терпи, химиотерапии и лучевой терапии;
- препараты прицельно действуют на клетку-мишень, новые лекарства всё более и более специфичны по отношению к опухолевым клеткам и значительно не изменяют метаболизм здоровых клеток.
Недостатки:
- дороговизна лекарств;
- не исключены серьёзные побочные эффекты, которые могут потребовать немедленного врачебного вмешательства;
- требуется проведение дорогостоящих исследований и генотипирование для подбора дозы и препарата.
Развитие молекулярной онкологии подтолкнуло учёных к разработке новых препаратов для лечения злокачественных новообразований. Благодаря усилиям исследователей многих стран за последние десятилетия в клиническую практику были внедрены десятки новых препаратов, которые дают эффективный результат.
Большое количество лекарств сейчас проходит разные стадии клинических испытаний и готовится к выходу на фармацевтический рынок и применению для терапии рака. Современный подход к лечению онкологических заболеваний является комплексным, и в приоритете стоит ранняя диагностика.
Оценка статьи
Мы приложили много усилий, чтобы Вы смогли прочитать эту статью, и будем рады Вашему отзыву в виде оценки. Автору будет приятно видеть, что Вам был интересен этот материал. Спасибо!
(14 4,36 из 5)
Загрузка…
Если Вам понравилась статья, поделитесь ею с друзьями!
Источник: https://UstamiVrachey.ru/onkologiya/targetnaya-terapiya
