Эпидемиология рака шейки матки
Рак шейки матки: как спастись?
Владимир Борисович, хотелось бы начать со статистики. Какую тенденцию вы наблюдаете – рост или спад?
В России мы долгое время шли вместе со странами третьего мира по уровню заболеваемости раком шейки матки – он в структуре онкогинекологических болезней был на первом месте. Но в последнее время отодвинулся на 2-ое, а на первое вышел рак матки.
Объяснить это можно с распространением другого заболевания – ожирения, рак матки связан с ним. В Америке, кстати, такая же ситуация. В мире около полмиллиона женщин заболевает раком шейки матки ежегодно, и 250 тысяч, то есть 50% из них, умирает от этого заболевания.
К сожалению, чаще всего ко врачам обращаются на поздних стадиях, потому что мало кто знает про скрининг, про вакцинацию, либо эти процедуры оказываются недоступны. В отношении вакцинации мы так и остались страной третьего мира.
В России охват вакцинацией всего лишь 8-9%, в Новой Зеландии, например, около 80-90%.
Вы сказали, что 50% заболевших умирает во всем мире, а есть ли у Вас цифры, как это обстоит в России?
Если честно, я не очень верю российской статистике, предпочитаю ориентироваться на американские данные. В Америке вакцинация внедрена достаточно широко, также доступны скрининговые программы, и там смертность не 50%, а около 30%.
Причины рака шейки матки
Считалось, что эрозия – одна из причин развития рака шейки матки. Так ли это? Что является его настоящей причиной?
Эрозия действительно считалась фоновым заболеванием, говорилось о предраковом состоянии. Это не так. Если в организме нет вируса папилломы человека (ВПЧ), эрозия вне зависимости от размера никогда не разовьется в рак шейки матки.
5% эрозий довольно большие, у пациенток могут появляться кровяные выделения после полового контакта. И это единственное основание для процедуры прижигания. Все остальные эрозии при отрицательном тесте на ВПЧ и нормальной цитологии не требуют особого лечения.
Единственная причина рака шейки матки – это онкогенные типы папилломавируса.
То есть у девственниц не может быть рака шейки матки?
ВПЧ может проникать на плоский эпителий не только при полноценном вагинальном сексе. Телесный контакт при альтернативных формах секса также может стать причиной инфицирования ВПЧ, и, соответственно, развития связанных с ним заболеваний.
Защищает ли презерватив от ВПЧ?
Презерватив защищает от инфекций, которые живут в сперме. Папилломавирус живет на плоском эпителии, поэтому презерватив не может от него защитить.Наследственность относится к факторам риска рака шейки матки?
Болеют раком шейки матки вне зависимости от семейного анамнеза. Пациентки часто говорят, что у их мамы тоже была дисплазия или рак шейки матки. Но это не основание полагать, что здесь играет роль наследственный фактор, просто заболевание очень распространено.
Какие болезни папилломавирус вызывает у мужчин?
Мужчины являются, в основном, переносчиками вируса, у них реже развиваются онкологические заболевания, связанные с ВПЧ. Но в Новой Зеландии и скандинавских странах вакцинация от ВПЧ охватывает и женское, и мужское население. Это уже дало колоссальные результаты: за последние 5 лет в странах заметно снижение предрака и рака шейки матки.
Онкогенные типы впч
Расскажите подробнее о типах ВПЧ, какие из них онкогенны?
Организм человека может населять 100 разных типов папилломавируса. Родинки на шее, бородавки у детей на руках – всё это они. Но вирусы, которые живут на шее и на ладонях, никогда не «ходят» вниз, и наоборот. Гинекологический тракт у женщин и урологический у мужчин населяют другие типы ВПЧ, их около 40.
Из них всего 15 относят к высокоонкогенным типам, то есть, у них есть потенциал изменять клетку. В основном, тесты проводят на 16-ый тип и 18-ый – они становятся причиной 70% онкологических заболеваний. Онкогенные типы ВПЧ со временем могут вызывать тяжелую дисплазию, которая может перейти в рак.
К низкоонкогенным относятся 6-ой и 11-ый тип. Они не проникают в ДНК клетки и не изменяют ее, мы их не боимся. Поэтому нет смысла знать, есть ли в организме ВПЧ, вызывающие папилломы и бородавки.
Но если мы находим ВПЧ высокого риска, это заставляет нас поинтересоваться, нет ли какие-то изменений в шейке матки.
Что делать женщинам до 30 лет, у которых обнаружен высокоонкогенный тип ВПЧ, например, 16-ый?
Эти данные ни на что не влияют. Моя тактика ведения пациентки в возрасте до 30 лет никак не поменяется, если я увижу положительный результат на ВПЧ. 80% вероятности, что через год у нее уже не будет этого 16-го типа, нет смысла сейчас тратить время и силы.
Этот вирус у женщин до 30 лет может самоэлиминировать, то есть, пропасть. После 30 лет это явление наблюдает гораздо реже.
Поэтому пациенток, не достигших этого возраста, я приглашаю на вакцинацию, но не делаю кольпоскопию или биопсию, только цитологию, то есть, ПАП-тест.
Симптомы рака шейки матки
Можно ли заподозрить у себя рак шейки матки? Есть ли определенные симптомы?
Дисплазия – это изменение в строении клеток эпителия. Она не вызывает симптомов. Дисплазии мы находим с помощью ПАП-тестов и тестов на ВПЧ, иногда при осмотре видим изменения. У раннего микроскопического рака шейки матки особых симптомов нет, когда появляется опухоль на шейке, могут возникнуть выделения, иногда кровянистые, иногда с запахом.
Скриниг на рак шейки матки
С какого возраста нужно начинать скрининг?
Мазки на цитологию начинают сдавать с 21 года. Верхней возрастной границы нет. Сейчас все больше пожилых людей ведет активную половую жизнь, поэтому и нет верхнего потолка, когда можно заканчивать проходить скрининг.
С 30 лет сдается ПАП-тест (тест Папаниколау) и тест на папилломавирус. Обычно, если у пациентки не выявлен ВПЧ, ей рекомендуют в следующий раз пройти те же исследования через три года. Но часто пациентки забывают, приходят позже, уже с дисплазией.
Поэтому мы, как правило, рекомендуем женщинам после 30 проходить эти исследования ежегодно.
Снижается ли возрастная планка для начала исследований, если девушка рано начала половую жизнь?
Нет. Есть огромная выборка пациентов, которая показывает, что после 21 года вероятность развития рака шейки матки кратно увеличивается, возраст в 21 год абсолютно популяционно выверен. А анализ на ВПЧ, взятый до 30 лет, только повышает тревогу.Почему скрининг включает два исследования: ПАП-тест и тест на ВПЧ?
ПАП-тест – это цитологическое исследование. При носительстве ВПЧ 16 или 18 типа даже при нормальной цитологии вероятность найти тяжелую дисплазию около 15%. Именно поэтому в скрининг добавили ВПЧ-тестирование для женщин старше 30 лет.
Чувствительность онкоцитологии для выявления дисплазии (ПАП-тест) – 80%, это означает, что 20% женщин, у которых дисплазия, уйдут от нас на год с нормальным мазком, и будут думать, что у них все хорошо. Но 20% – очень много.
ПАП-тест и ВПЧ-тест позволяет выявлять 95% существующих проблем.
Вакцины от папилломавируса
Стоит ли доверять вакцинам от ВПЧ?
Предпосылок для недоверия никаких нет. Часто слышу мнение, что вакцина не исследована. На самом деле более изученную вакцину трудно найти. Вообще-то препарат на рынке с 2001 года, до этого было ещё 5 лет клинических испытаний, то есть, мы про нее знаем, около 24 лет.
В мире вакцинированы миллионы женщин, мы отслеживаем состояние первых вакцинированных, уровень их антител, мы знаем все побочные эффекты препарата. Также есть аргументы, что вакцина не изучена именно на русских женщинах. Иногда на приеме даже очень образованные женщины спрашивают, не вызывает ли вакцина бесплодие.
В таких случаях я точно знаю, что они успели прочитать! Связь у вакцинированных, например, в 9 лет девочек, с бесплодием, скажем, в 30 лет, очень сомнительна. Потому что за эти 20 лет произошло огромное количество событий, и вклад вакцинации в бесплодие определить невозможно. Самое главное, что никаких данных про это нигде в научной литературе нет.
Но почему-то конспирологическая теория, мол, американцы создали вакцину, чтобы русского народа стало меньше до сих пор живет, и это очень печально.
Первая вакцинация нужна девочкам в 9 лет. А когда делать прививку уже поздно?
В 45 лет.
Насколько хорошо вакцина будет защищать женщину, которая вакцинировалась, скажем, в 30 лет?
К 30 годам многие женщины уже обзавелись папилломавирусом. Вакцина его не лечит, но она предотвращает заражение его новыми типами. На американском и европейском рынках есть девятивалентная вакцина, которая в России пока не сертифицирована. Она защищает от 7 типов восокоонкогенного риска.
В отличие от нее, четырехвалентная защищает только от двух. Женщины, которые, допустим, являются носителями ВПЧ 31 типа, получат колоссальную пользу от 9-валентной вакцины, поскольку она защитит их от 6 других типов. Известен феномен самоэлиминации вируса: 80% женщин в возрасте до 30 «теряют» ВПЧ.
Поэтому можно вакцинировать 30-летних, но лишь для того, чтобы предотвратить заражение новыми типами вируса. Причем перед вакцинацией женщину не тестируют на ВПЧ – уже неважно, какой тип вируса уже есть в организме.
Вакцина от ВПЧ в США и Европе введена в Национальный календарь прививок, а у нас вопрос о вакцинации остается, по сути, на совести акушера-гинеколога, к которому попадет пациентка, либо на совести самой пациентки.руководитель Клиники гинекологии и онкогинекологии Европейского медицинского центра Владимир Носов
Лечение рака шейки матки
Возможно ли вылечить папилломавирус?
Вылечить папилломавирус невозможно. Надо бежать подальше от врача, который назначает лечение ВПЧ иммуномодуляторами, БАДами, фотодинамической терапией. У нас целая индустрия работает на эти препараты. Собственно, это, возможно, одна из причин, почему у нас не хотят продвигать вакцинацию.
Можно ли пациенткам с диагнозом рак шейки матки рассчитывать на будущую беременность? Какие новые методы лечения появились в последние годы?
Все молекулярные, таргетные методы на сегодняшний день, к сожалению, разработаны только поздних стадий и рецидивов заболевания. Например, при рецидивах химиотерапия оказывается слишком токсичной, но хорошо работает иммунотерапия. Сегодня хирургия предлагает органосохраняющие методы лечения рака шейки матки.
Это заболевание достаточно молодых женщин, средний возраст пациенток 41 год, многие еще не завели детей. Задача онкогинеколога на этапе планирования лечения обсудить опцию органосохраняющей операции. К счастью, на первой стадии нам не надо выбирать между прогнозом жизни и сохранением фертильности.
Операция называется трахелэктомия, она появилась еще 15 лет назад, но сегодня мы можем проводить ее в отдельных случаях даже на роботе Да Винчи. Врачи удаляют шейку с опухолью, окружающими ее тканями и лимфоузлами, но оставляют матку, соединяют ее с влагалищем. После такой операции женщина может забеременеть.
Около 80% женщин рожают в 3 триместре.
Какие методы применяются для лечения рака шейки матки 2 и 3 стадий?
Мы называем операбельной стадией только 1 стадию рака шейки матки. Операбельность не надо путать с излечимостью. Многие пациентки говорят: опухоль неоперабельна, следовательно, неизлечима. Это совсем не так. На 2-ой (неоперабельной) стадии 70% женщин излечивается полностью.
Стандартом лечения является химиолучевая терапия. За последние 15 лет она претерпела колоссальные изменения. Например, появилась IMRT – лучевая терапия с модулированной интенсивностью. У каждого здорового органа свой предел дозы радиации, которую он может вынести.
Однако опухоль должна получить облучение, превышающее эти нормы. При IMRT радиофизики рассчитывают предельно допустимую дозу для каждой точки, и доставляем в опухоль до 100 грей, не затрагивая при этом мочевой пузырь и кишку. Несколько лет назад для пациенток с 3-ей стадией прогноз жизни не превышал 2 лет.
Но сейчас они приходят на наблюдение и через 4 года, и через 5 лет. Недавно Европейское общество онкогинекологов наконец-то опубликовало статью, в которой говорится, что эта нетравматичная техника очень эффективна и нетоксична, и скоро, надеемся, станет стандартом лечения. Это колоссальный прорыв.Это то, куда движется сейчас наука: селективность, избирательность, таргетности лучевой терапии.
Однако каждый раз, когда я вижу рак шейки матки, я понимаю, что это – упущенная возможность. В отличие от большинства онкологических заболеваний, этот рак можно предотвратить, и у нас есть все инструменты для неинвазивного раннего выявления злокачественных новообразований.
Авторы:
Источник: https://tobewell.info/interview/rak-sheyki-matki-kak-spastis/
Эпидемиология рака шейки матки
Рак шейки матки (РШМ) занимает второе место среди злокачественных новообразований женских репродуктивных органов.
Опухоли шейки матки — одна из немногих локализаций, где усилия медицинских работников, направленные на первичную и вторичную профилактику, раннюю диагностику и лечение, могут на ранних этапах существенно повлиять на показатели заболеваемости.
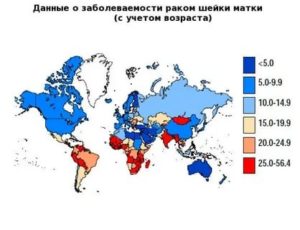
Обратившись к диаграмме, отражающей мировую заболеваемость, мы увидим, что Россия относится к числу стран с недостаточно эффективно работающими скрининговыми программами.
Рис. 4. Заболеваемость и смертность от рака шейки матки в различных странах.
Кроме показателей заболеваемости и летальности нам хотелось бы отразить соотношение стадий опухолей шейки матки на момент диагностики (рис. 5). Ведь именно возможность диагностировать «ранние» раки определяет успехи в практической онкологии.
Рис. 5. Распределение по стадиям злокачественных новообразований шейки матки в Омской области.
Примерно равное соотношение ранних опухолей с местнораспространёнными и распространёнными процессами является своеобразным показателем не высокой эффективности работы скрининговой программы в Омском регионе. В странах с эффективным скринингом удалось не только снизить заболеваемость опухолями шейки матки, но и свести к минимуму количество больных с III-IV стадиями заболевания.
Этиология, патогенез и факторы риска
Одним из самых важных достижений в изучении этиологии рака принято считать установление факта причинной связи между папилломавирусной (HPV) инфекцией и РШМ. Это открытие по своей значимости находится в одном ряду с обнаружением роли табакокурения при раке лёгкого, а также роли хронической вирусной инфекции при гепатитах В и С в этиологии первичного рака печени.
Знания о роли HPV — инфекции в канцерогенезе позволяют сегодня отнести рак шейки матки к заболеваниям, обусловленным вирусной инфекцией, которая передаётся половым путём. Иллюстрирует это утверждение то, что при РШМ в 90-100% случаев в опухолевом материале обнаруживается ДНК HPV, в то время как инфицированность в популяции здоровых женщин не превышает 5-20%.
Известно, что 95% неоплазий шейки матки содержат разновидности HPV, принадлежащие к так называемым типам «высокого онкологического риска». Все папилломавирусы человека разделяются на «кожные» и «слизистые». К кожным относится большинство папилломавирусов, вызывающих, в частности, бородавки. Наибольший интерес среди «слизистых» вызывают HPV, инфицирующие аногенитальную область.
Аногенитальные HPV принято разделять на вирусы «низкого» и «высокого» онкогенного риска:
1) HPV низкого риска обычно ассоциированы с доброкачественными генитальными бородавками;
2) HPV высокого риска обнаруживаются в 95-100% преинвазивных и инвазивных формах рака шейки матки.
Распространение инфекции происходит преимущественно половым путём. Быстрый подъём HPV-инфекции отмечается среди женщин 15-25 лет, то есть в период начала половой жизни. Более 50% сексуально активного населения мира в течение жизни инфицируются вирусом папилломы человека, и это является «первичным» событием в патогенезе рака шейки матки.
Большинство случаев инфицирования заканчивается спонтанным выздоровлением. Однако в некоторых случаях развивается персистирующая инфекция, способная запускать процессы клеточной трансформации эпителиальных клеток. При цервикальной интраэпителиальной неоплазией I (CIN I) наблюдается активная репликация вируса и его бессимптомное выделение.
Превращение CIN III в инвазивный рак происходит с большой частотой и сопровождается интеграцией вирусной ДНК в геном клетки хозяина. Опухолевая трансформация происходит с большей вероятностью при взаимодействии ВПЧ с другими канцерогенными и инфекционными агентами (вирусные инфекции).
Проведённые специальные эпидемиологические исследования позволили предположить следующие факторы риска развития плоскоклеточного рака шейки матки и его предшественников (именно плоскоклеточные раки составляют около 95% всех злокачественных новообразований шейки матки):
1) раннее начало половой жизни; 2) сексуальная активность; 3) частая смена половых партнёров не только самой женщиной, но и её партнёрами мужчинами; 4) несоблюдение половой гигиены; 5) половые бактериальные и вирусные инфекции; 6) курение табака; 7) иммунодефицит; 8) дефицит в пище витаминов А и С;
9) возможно, использование оральных контрацептивов.
Скрининг
РШМ является одной из немногих нозологических форм злокачественных новообразований, которые удовлетворяют всем требованиям для проведения популяционного скрининга. После классических работ, выполненных Папаниколау в 40-х годах, было показано, что цитологический метод исследования весьма чувствителен для диагностики предрака и начального преклинического рака шейки матки.
Одним из важнейших факторов оценки эффективности цитологического скрининга является охват женского населения.
В странах, где проводится организованный скрининг, уровень охваченных программой женщин составляет 75-90%.
Относительно частоты проведения скрининговых исследований по рекомендациям ВОЗ идеальным считается скрининг женщин 25-65 лет сначала 2 года подряд, при отрицательных результатах — каждые 3 года.В России в течение последних 20 лет программа скрининга не изменялась. Приказом МЗ регламентированы ежегодные осмотры всех женщин с 18 лет и старше с проведением цитологического исследования мазков с шейки матки и цервикального канала.
Забор материала с шейки матки у женщин репродуктивного возраста осуществляется не ранее 5-го дня менструального цикла и не позднее, чем за 5 дней до предполагаемой менструации. Мазки берутся до бимануального исследования и различных проб, нельзя брать мазки в течение 24 часов после полового сношения, спринцевания, введения во влагалище медикаментов и кремов.
Материал берётся с наружной части шейки матки и цервикального канала, захватывая зону трансформации. Без предварительной обработки шейки матки, инструментом (шпатель Эйра, Brush-системы, поролоновая губка) вращательным движением получают соскоб с экто-, эндоцервикса и зоны перехода одновременно (рис. 6, 7).
Рис. 6. Шпатель Эйра позволяет получить материал для цитологического исследования из цервикального канала и с влагалищной полости шейки матки одним поворотом на 360°.
Рис. 7. Взятие материала для цитологического исследования из цервикального канала с помощью цитощеточки.
Затем материал одним движением переносят на маркированное предметное стекло. При наличии патологии шейки матки материал берут непосредственно с участков поражения.
То, что в 25% случаев у больных моложе 35 лет рак шейки матки сочетается с беременностью, свидетельствует о необходимости использования цитологического исследования у пациенток, наблюдающихся по беременности.
Клинические проявления рака шейки матки
Клиническая картина рака шейки матки неспецифична и сводится к следующим основным симптомам:
1) контактные кровянистые выделения из половых путей; 2) патологические выделения, характерные для воспалительных процессов; 3) жидкие зловонные выделения, характерные для распадающихся опухолей;
4) расстройство со стороны соседних органов (мочеточники, мочевой пузырь, прямая кишка).
Изменения со стороны шейки матки, наблюдаемые при осмотре в зеркалах, зависят от формы роста (эндофитная, экзофитная, смешанная).
При наиболее часто встречающейся эндофитной форме шейка матки гипертрофируется, приобретает бочкообразную форму, становится плотной, малоподвижной.Поверхность опухоли обычно гладкая, слизистая влагалищной части шейки матки цианотичная или тёмно-багровая с выраженной сетью капилляров. Реже встречается экзофитная форма роста, при которой имеются мелкососочковые разрастания на шейке матки типа «цветной капусты».
Опухоль обычно кровоточит при «дотрагивании» (контактное кровотечение). Эта форма отличается ранней симптоматикой. Смешанная форма характеризуется сочетанием инфильтративного роста с экзофитным. Язвенно-инфильтративная форма обычно является показателем запущенности процесса (III-IV стадия) чаще при эндофитных, реже при смешанных и экзофитных процессах.
По гистологическому строению абсолютное большинство злокачественных новообразований шейки матки имеют плоскоклеточную форму (95-98%) и развиваются из многослойного плоского эпителия, в норме покрывающего влагалищную порцию шейки матки. У 2-5% больных первично развивается аденокарцинома, растущая из эпителия цервикального канала.
Диагностика
Рассматривая вопросы ранней диагностики, необходимо более подробно остановиться на фоновых и предраковых процессах шейки матки, а также методах их диагностики и лечения.
Одним из наиболее распространённых, доступных и недорогих методов исследования шейки матки является кольпоскопия — исследование эпителия шейки матки и влагалища с помощью специального прибора кольпоскопа (рис. 9) при увеличении в 7-28 и более раз.
Рис. 9. Внешний вид кольпоскопа.
В процессе копьпоскопии:
1) оценивается состояние эпителия шейки матки и влагалища; 2) выявляется очаг поражения; 3) дифференцируются доброкачественные изменения от подозрительных на малигнизацию;
4) осуществляется прицельное взятие цитологических мазков.
Именно кольпоскопии отводится большая роль в диагностике предопухолевых состояний шейки матки, поскольку последние могут возникать как на неизменённой шейке матки, так и в области фоновых процессов. Конечным этапом комплексного обследования является гистологическое исследование.
Биопсия шейки матки
Требования, предъявляемые экспертами ВОЗ к биопсии шейки матки, сводятся к двум основным моментам:
1) биопсия выполняется с помощью скальпеля, и недопустимо выполнение биопсии шейки матки конхотомом;
2) при подозрении на злокачественный процесс недопустимы многократные биопсии шейки матки.
Диагностическое выскабливание слизистой цервикального канала. Традиционно забор материала из цервикального канала осуществляется после зондирования полости матки и дилатации канала расширителями Гегара. Но после выполнения внутриматочных манипуляций в материале могут оказаться элементы эндометрия, что искажает картину соскоба эндоцервикса.
Более адекватным видится выполнение выскабливания цервикального канала без расширения области внутреннего зева и до зондирования полости матки. Именно таким образом удаётся получить чёткое представление о характере изменений шейки матки.
Для уточнения характера и распространённости патологического процесса обследование этой категории больных целесообразно дополнить взятием материала из полости матки с последующим гистологическим и/или цитологическим исследованием.Источник: https://UziMaster.ru/jepidemiologija-raka-shejki-matki/
Диагностика предрака и рака шейки матки

Рак шейки матки в структуре смертности от злокачественных новообразований в нашей стране является причиной смерти 24% женщин в возрасте от 30 до 39 лет и 13,7% женщин в возрасте от 40 до 49 лет.
Доказано, что заболевания шейки матки, в том числе рак шейки матки, в основном ассоциированы с вирусом папилломы человека (ВПЧ). Именно длительная персистенция этого вируса в тканях органов нижнего отдела генитального тракта провоцирует развитие предраковых и раковых процессов шейки матки.
В мире около 630 млн человек инфицировано ВПЧ. Большинство женщин инфицируются им вскоре после начала половой жизни. Уже через два года после сексуального дебюта до 82% женщин считаются инфицированными, 20% женщин — из тех, кто имел только одного партнера. По данным Всемирной организации здравоохранения, 3/4 сексуально активных женщин поражается этим вирусом хотя бы один раз в своей жизни.
Пик инфицирования ВПЧ приходится на наиболее сексуально активную часть населения – подростков и молодых женщин в возрасте 16–25 лет. Факторами риска инфицирования и развития предрака и рака шейки матки являются:
- раннее начало половой жизни;
- три и более половых партнеров в течение года и более шести половых партнеров в течение жизни;
- курение;
- употребление алкоголя;
- воспалительные заболевания шейки матки;
- частые роды и аборты;
- авитаминозы;
- низкий социально-экономический уровень жизни;
- иммунодефицитные состояния (ВИЧ);
- трансплантация органов и др.
Профилактика рака шейки матки
Профилактика и ранняя диагностика предрака и рака шейки матки направлены на снижение заболеваемости и смертности. Выделяют первичную и вторичную профилактику.
Первичная профилактика – это система мер по выявлению факторов риска развития рака шейки матки и их устранению. Сюда входит:
- пропаганда здорового образа жизни,
- повышение медицинской грамотности населения,
- борьба с курением,
- использование барьерных методов контрацепции,
- выявление факторов риска распространения ВПЧ и других инфекций, передающихся половым путем,
- разработка и внедрение профилактических вакцин.
Вторичная профилактика – раннее выявление изменений эпителия, обусловленных ВПЧ, для предотвращения развития предрака и рака шейки матки – осуществляется с помощью скрининга.
Методы скрининга рака шейки матки
Скрининг – метод, который используется с целью выявления определенного заболевания или факторов, способствующих развитию данного заболевания, и носит одномоментный или поэтапный характер. Необходимо отличать скрининг от ранней диагностики – выявления заболевания у лиц, которые сами обратились за медицинской помощью после появления у них жалоб и симптомов заболевания.
Цель скрининга рака шейки матки – активное выявление признаков рака шейки матки в преклинической фазе и его лечение органо- и тканесберегающими методами, что позволяет сократить сроки лечения, уменьшить риск инвалидизации и смертности.
Скрининг предрака и рака шейки матки может быть организованным и оппортунистическим.
- Организованный скрининг более эффективен и экономичен, поскольку разрабатывается на государственном уровне, осуществляется по утвержденной программе и позволяет широко охватить население.
- Оппортунистический скрининг – обследование женщин, пришедших на прием к гинекологу, – имеет низкую эффективность.
Критериями оценки эффективности скрининга рака шейки матки являются снижение показателей заболеваемости раком шейки матки, показателей смертности от рака шейки матки, а также изменение структуры заболеваемости.
Преимущества цитологического скрининга
Цитологический скрининг признан классическим методом и рекомендован ВОЗ для проведения в масштабах национальных программ.
Во многих развитых странах широкое внедрение скрининговых программ позволило своевременно выявить и назначить адекватное лечение предопухолевых состояний шейки матки, а в результате снизить заболеваемость и смертность от рака шейки матки. При правильно организованном процессе эффективность его достаточно высока.
В России в настоящее время организованный скрининг не проводится. Цитологический скрининг предрака и рака шейки матки осуществляется только при диспансеризации, которая вновь стала обязательной с 2013 г.. Для детей, студентов и ветеранов ВОВ предусмотрена ежегодная диспансеризация, с 21 года рекомендуется обследоваться один раз в три года.
Согласно российским рекомендациям скрининг на рак шейки матки рекомендуется проводить с 25 до 65 лет с интервалами каждые 3 года у женщин моложе 50 лет и каждые 5 лет у женщин 50–65 лет.
- Вакцинация не является причиной отказа от регулярного скрининга.
- В обязательном порядке его должны проходить женщины:
- с тотальной гистерэктомией по поводу доброкачественных заболеваний матки,
- с субтотальной гистерэктомией,
- с гистерэктомией по поводу инвазивного цервикального рака,
- с указанием на цервикальные интраэпителиальные неоплазии второй и третьей степени в анамнезе.
В настоящее время для проведения скрининга рака шейки матки используются следующие тесты:
- мазок (тест) Папаниколау ,
- жидкостная цитология,
- ВПЧ-тест (методом ПЦР),
- визуальный метод с взятием проб (альтернатива для развивающихся стран).
Мазок Папаниколау – основа цитологического скрининга
Широкое применение в клинической практике мазка Папаниколау обусловлено рядом причин. Метод хорошо изучен, давно и широко используется, что позволило разработать программы обучения персонала и контроля качества.
Тест обладает 85%-ной специфичностью и 66%-ной чувствительностью.
К недостаткам метода можно отнести отсроченность результатов и возможность получения ложноотрицательных результатов (причины: 70–90% – плохой забор материала для цитологического исследования, 10–30% – ошибочная интерпретация данных).
Для эффективной цитологической диагностики очень важно получить полноценный мазок, так как неправильное взятие материала и неправильное приготовление препарата могут привести к ошибочному цитологическому диагнозу. Напомним основные правила взятия мазка: его необходимо брать с поверхности экзоцервикса, переходной зоны и из эндоцервикса.
Мазок не следует брать ранее 48 часов после полового контакта, а также использования лубрикантов, раствора уксуса или Люголя, тампонов или спермицидов, во время менструации, в период лечения другой генитальной инфекции, после вагинального исследования, спринцевания, ультразвукового исследования.
Правильно и качественно взять материал помогают специальные инструменты – шпатели или специальные щеточки для забора цитологического материала.
Жидкостная цитология
В настоящее время все большее распространение получает метод жидкостной цитологии, который обладает такими преимуществами:
- размещение материала не на стекле, а в транспортной жидкости;
- сохранение морфологических, иммуноцитохимических и генетических свойств клеток;
- тонкослойный мазок (он не загрязнен воспалительными и кровяными элементами);
- более высокая чувствительность по сравнению с мазком Папаниколау;
- возможность компьютерной интерпретации большого числа мазков;
- возможность одновременного исследования клеточного материала из одного флакона на ВПЧ (ВПЧ-тест) и цитологию (мазок Папаниколау);
- возможность проведения дополнительных, уточняющих исследований, например выявления иммуноцитохимических биомаркеров p16 и Ki-67.
Для интерпретации результатов цитологического исследования мазков с шейки матки используют классификацию по Папаниколау и терминологическую систему Бетесда (2001).
В классификации по Папаниколау описано пять цитологических картин:
- первая – нормальная цитологическая картина;
- вторая – изменение морфологии клеток (небольшое увеличение ядра и появление клеток метаплазированного эпителия), обусловленное воспалительным процессом во влагалище и (или) шейке матки;
- третья – единичные клетки с аномалией ядер и цитоплазмы (дискариоз) – подозрение на злокачественное новообразование;
- четвертая – отдельные клетки с явными признаками озлокачествления;
- пятая – большое число типично раковых клеток – диагноз злокачественного новообразования не вызывает сомнений.
Недостатком данной классификации является то, что в ней не учитываются цитологические изменения, обусловленные ВПЧ. Терминологическая система Бетесда была предложена, когда была изучена роль ВПЧ в генезе рака шейки матки.
Согласно системе Бетесда начальным компонентом интерпретации цервикальных мазков является оценка адекватности образца, так как его качество влияет на чувствительность цитологического метода.
Система предполагает два вида образцов: удовлетворительный (наличие или отсутствие компонента эндоцервикса/зоны трансформации) и неудовлетворительный.
https://www.youtube.com/watch?v=Jo99Qm6fQ8Y
В системе выделено три категории мазков:
- норма,
- мазки неопределенного значения,
- мазки с внутриэпителиальными поражениями (предраковые) низкой и высокой степени.
ВПЧ-тест
В результате подтверждения этиологической роли ВПЧ в развитии рака шейки матки тестирование на ВПЧ стало обязательным элементом скрининга этого заболевания.
Во многих клинических исследованиях было показано, что ВПЧ-тест на выявление ДНК-содержащих вирусов дает возможность количественного определения ДНК ВПЧ, вирусной нагрузки, обладает высокой чувствительностью при поражениях высокой степени (80–100%). В США он является обязательным скрининговым методом для женщин после 30 лет.
ВПЧ-тест как метод первичного скрининга может быть рекомендован только в случае первичного обследования, случайного мониторинга, его следует проводить параллельно с жидкостной цитологией или другими скрининг-тестами. Данный метод нельзя использовать при диагностике женщин до 30 лет.
Визуальный метод оценки
Визуальный метод оценки основан на осмотре шейки матки после применения 3%-ного раствора уксусной кислоты и пробы Шиллера. К достоинствам данного метода относятся его простота и доступность, низкая цена, возможность немедленной оценки результатов, а к минусам – субъективность в оценке результатов, чувствительность 67–79%, специфичность 49%.Методы визуального скрининга рекомендованы к применению только при первичном исследовании или случайном мониторинге. Данный метод малоэффективен у пациенток в постменопаузе [8].
Кольпоскопия
Кольпоскопия – высокоинформативный и недорогой метод ранней диагностики заболеваний шейки матки, с его помощью можно обнаружить аномальный эпителий на шейке матки, стенках влагалища и вульве.
Его чувствительность составляет 45–65%, специфичность – 10–48%.
Точность кольпоскопического заключения зависит от опыта врача, но даже грамотные специалисты ошибаются в 26–42% случаев при наличии цервикальной интраэпителиальной неоплазии второй степени.
Гистологический метод
«Золотым стандартом» диагностики предрака и рака шейки матки считается гистологический метод, но его широкое использование ограничено высокой стоимостью, невозможностью использовать многократно и тем, что он не является скрининговым (используется в клинической практике только на этапе окончательной постановки диагноза).
Оригинал: на umedp.ru
Источник: https://www.vitasite.ru/articles/lady_article/diagnostika-predraka-i-raka-shejki-matki/
