Что такое провирусная днк вич
Ворота для инфекции. Встроится ли новый коронавирус в ДНК человека
https://ria.ru/20200316/1568576203.html
Ворота для инфекции. Встроится ли новый коронавирус в ДНК человека
Почти восемь процентов ДНК человека приходится на фрагменты древних вирусов. Одни привели к полезным мутациям, повлиявшим на эволюцию, другие — к болезням… РИА Новости, 16.03.2020
2020-03-16T08:00
2020-03-16T09:30
генетика
риа наука
эволюция
геном
днк
биология
здоровье
открытия — риа наука
московский физико-технический институт
/html/head/meta[@name='og:title']/@content
/html/head/meta[@name='og:description']/@content
https://cdn22.img.ria.ru/images/07e4/03/10/1568650541_0:222:2982:1899_1400x0_80_0_0_0062a696f5decb8212954aae7ea9467c.jpg
https://ria.ru/20160323/1395536650.html
https://ria.ru/20131119/977997043.html
https://ria.ru/20170110/1485396612.html
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn22.img.ria.ru/images/07e4/03/10/1568650541_0:222:2982:1899_1400x0_80_0_0_0062a696f5decb8212954aae7ea9467c.jpg
https://cdn21.img.ria.ru/images/07e4/03/10/1568650541_0:0:2732:2048_1400x0_80_0_0_69fe7d36a01a55055f8ebfcdb651efe7.jpg
https://cdn23.img.ria.ru/images/07e4/03/10/1568650541_40:0:2088:2048_1400x0_80_0_0_1107ad48fc7f2f8c9c813e180e9df5d3.jpg
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
генетика, эволюция, геном, днк, биология, здоровье, открытия — риа наука, московский физико-технический институт
МОСКВА, 16 мар — РИА Новости, Альфия Еникеева. Почти восемь процентов ДНК человека приходится на фрагменты древних вирусов.
Одни привели к полезным мутациям, повлиявшим на эволюцию, другие — к болезням. Изучая эти вирусные элементы, генетики доказали, что люди в прошлом не раз благополучно переживали опасные пандемии.Чем грозит нашему геному новый коронавирус — в материале РИА Новости.
Засоренный геном
В человеческом геноме содержится около 98 тысяч эндогенных ретровирусных элементов (ЭРВ) — последовательностей ДНК древних вирусов, которыми когда-то заражались наши предки.
По разным данным, ЭРВ объединяются в 30-50 семейств, которые, в свою очередь, подразделяются почти на двести групп и подгрупп. И лишь менее одного процента ЭРВ встречается только у человека.
То есть они встроились в геном уже после того, как ветви людей и шимпанзе разделились. По подсчетам, последний ретровирус, сумевший стать частью нашей ДНК, инфицировал человеческую популяцию около 150 тысяч лет назад.
Судя по его первоначальному геному, который удалось восстановить сразу двум группам ученых, это был крайне заразный экзогенный ретровирус. Иными словами, сотни тысяч лет назад наши предки пережили настоящую пандемию.
«В геном интегрировались только те вирусы, которые обладали механизмом обратной транскрипции, то есть умели из РНК делать ДНК. Поэтому их еще называют ретровирусами.
Когда такая частица проникала в клетку, превращала РНК в ДНК, а затем встраивала его в геном и оставалась там, как сейчас выясняется, на века. Но тут есть нюанс.
Эти древние вирусы могли инфицировать либо половые клетки, либо герминальные — из них на ранних стадиях эмбриогенеза образуются сперматозоиды и яйцеклетки. И это на самом деле нетривиальная задача, потому что большинству вирусных частиц половые клетки неинтересны. Их слишком мало.
Зато, попав в них, вирус размножается как горизонтально, так и вертикально — передаваясь потомкам хозяина. Но это бывает крайне редко», — объясняет РИА Новости заведующий лабораторией геномной инженерии МФТИ, вирусолог Павел Волчков.
Вирусная помощь
В 2014 году британские исследователи подсчитали, что за последние десять миллионов лет в геномах 38 видов животных осело больше 27 тысяч эндогенных ретровирусных элементов. Причем чем крупнее был организм, тем меньше ЭРВ встречалось в его ДНК.
Так, если у мыши обнаружили почти три с половиной тысячи вирусных вставок, то у человека — чуть больше тысячи, а у синего кита — и вовсе только 55.
Авторы работы предположили, что обилие этих вирусных участков в геноме потенциально опасно: они могут быть связаны с мутациями, в результате которых развиваются злокачественные опухоли. А чем крупнее животное, тем реже болеет раком.
Однако уже через год международная группа ученых доказала, ЭРВ — не вредный генетический мусор. Они играют важную роль в процессе развития эмбриона у приматов, а значит, и человека. Выяснилось, что у молекул РНК, транскрибируемых из межгенных участков ДНК, вирусная природа. И их блокировка полностью останавливает рост зародыша.
Следы эволюции
В начале нулевых расшифровали нуклеотидные последовательности ДНК многих видов животных. Оказалось, что все эндогенные вирусы расположены в строго определенных местах. Некоторые ЭРВ встречались лишь у человека или кошки, другие же были общими сразу для нескольких видов — скажем, человека, шимпанзе, гориллы и орангутана.
«Прослеживая интеграцию этих ретровирусов в нашу ДНК, можно понять, когда именно разошлись те или иные ветви эволюционно. Потому что встраивание вируса — это событие с конкретной датой, когда какой-то наш общий предок был инфицирован.
Вирус встроился в его геном, и теперь этот кусок ДНК есть у всех на планете. Понятно, что таких случаев в процессе эволюции у нас было много.
И одинаковое расположение одних и тех же вирусных вставок в геномах двух или более животных говорит о том, что они произошли от одного предка», — говорит Павел Волчков.
По его словам, хотя в геноме эти вирусы, как правило, неактивны, они могут провоцировать новые мутации, в том числе и полезные.
«При делении клеток ДНК постоянно повреждается. Для починки используются точно такие же области другой, сестринской хромосомы. Но из-за огромного количества повторяющихся эндогенных ретровирусов, интегрированных в наш геном, репарационный механизм может «перепутать» место.
В результате происходит либо транслокация (перестройка), либо инверсия, которые способны привести к мутации. Для отдельного индивидуума это играет нейтральную либо негативную роль.Но для видообразования это крайне важный процесс, поскольку так возникают новые гены», — отмечает ученый.
Согласно работе датских исследователей, подобным образом появились гены ENVV1 и ENVV2, управляющие слиянием клеток в процессе формирования наружного слоя плаценты. Также они защищают эмбрион от иммунной системы матери.
По подсчетам биологов, эти гены остались от древних вирусов, инфицировавших нашего далекого предка 50-70 миллионов лет назад. Российские ученые предполагают, что ЭРВ сыграли решающую роль в развитии умственных способностей Homo sapiens.
Так, один из вирусных элементов, встречающийся только в человеческой ДНК, расположен около гена PRODH и, судя по всему, усиливает его активность.
Этот ген кодирует фермент, связанный с синтезом одного из нейромедиаторов, который стимулирует передачу сигналов возбуждения в нервной системе. У наших ближайших родственников, шимпанзе, тоже есть PRODH, но нет ЭРВ, и этот ген у них менее активен.
Когда вирус внедряется в ДНК
Несмотря на значительное количество ЭРВ в геномах животных, вирусы довольно редко могут встроиться в ДНК половых клеток и закрепиться в ней навсегда, считают специалисты.
Поэтому вероятность того, что патогены, циркулирующие сегодня в человеческой популяции, — вирус Эбола, Зика или новый коронавирус — встроятся в геном, крайне мала.
Даже наиболее подходящий на эту роль ВИЧ, относящийся к семейству ретровирусов, не способен поражать половые клетки.
«Встроиться в геном может только ретровирус, имеющий ДНК-стадию. Правда, есть маленькое исключение: когда клетка одновременно заражается двумя инфекционными частицами, одна из которых относится к семейству ретровирусов. Но это достаточно случайное событие. Его нельзя отрицать, потому что следы таких событий у нас в геноме есть. Однако его вероятность близка к нулю», — пояснил Павел Волчков.
Источник: https://ria.ru/20200316/1568576203.html
Вирус иммунодефицита человека 1 типа (Human Immunodeficiency Virus, HIV) качественное определение ДНК провируса (цельная кровь)

array(19) { [«catalog_code»]=> string(6) «032101» [«name»]=> string(205) «Вирус иммунодефицита человека 1 типа (Human Immunodeficiency Virus, HIV) качественное определение ДНК провируса (цельная кровь)» [«period»]=> string(1) «2» [«period_max»]=> string(1) «7» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(4) «2537» [«id»]=> string(4) «1415» [«url»]=> string(64) «virus-immunodeficita-cheloveka-opredelenije-dnk-provirusa_032101» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи.
Можно пить воду без газа.
» [«opisanie»]=> string(6926) «
Метод исследования: ПЦР
ВИЧ-инфекция — инфекционное заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ) — Human Immunodefi ciency virus (HIV).
Характеризуется специфическим поражением иммунной системы, приводящим к формированию синдрома приобретенного иммунодефицита (СПИД).
Вирус иммунодефицита человека — РНК-содержащий вирус — относится к семейству ретровирусов. Существует два типа вируса: ВИЧ-1 и ВИЧ-2. ВИЧ-2 встречается значительно реже.
Обследование для выявления ВИЧ-инфекции проводится в соответствии с санитарно-эпидемиологическими правилами СП 3.1.5.2826-10 «Профилактика ВИЧ-инфекции».
Определение ДНК провируса методом ПЦР показано для обследования детей, рожденных от ВИЧ-инфицированных матерей (в возрасте до 18 месяцев); других категорий пациентов в случаях сомнительных результатов определения антител методом иммуноблота и положительных результатов определения антител методом ИФА. ДНК провируса ВИЧ присутствует в крови даже в случае недетектируемой вирусной нагрузки (недектируемое количество РНК ВИЧ).
ВИЧ-ИНФЕКЦИЯ: ДИАГНОСТИКА У ДЕТЕЙ, РОЖДЕННЫХ ОТ ВИЧ-ИНФИЦИРОВАННЫХ МАТЕРЕЙ
Определение ДНК провируса у детей, рожденных от ВИЧ-инфицированных матерей, желательно проводить в возрасте до 48 часов жизни, 1-2 месяца, 3-6 месяцев.
Получение положительных результатов определения ДНК ВИЧ в двух отдельно взятых образцах крови у ребенка старше 1 месяца является лабораторным подтверждением диагноза ВИЧ-инфекции.
Получение двух отрицательных результатов определения ДНК ВИЧ у ребенка в возрасте 1-2 месяцев и 4-6 месяцев (при отсутствии грудного вскармливания) исключает наличие ВИЧ-инфекции.Но снятие с диспансерного учета может осуществляться только в возрасте старше 1 года.
ВИЧ-ИНФЕКЦИЯ: РАННЯЯ ДИАГНОСТИКА ВОЗМОЖНОГО ИНФИЦИРОВАНИЯ
Определение ДНК провируса ВИЧ возможно использовать в ранней диагностике возможного инфицирования после эпизода повышенного риска (на 10-й день после потенциального инфицирования). Однако для полного исключения ВИЧ-инфекции необходимо в последующем проведение повторного исследования и серологической диагностики в сроки 4 и 12 недель.
Показания к исследованию:
- Обследование детей, рожденных от ВИЧ-инфицированных матерей (в возрасте до 18 месяцев);
- В случаях сомнительных результатов определения антител методом иммуноблота и положительных результатов определения антител методом ИФА.
Интерпретация результатов:
Референсные значения (вариант нормы):
| ДНК ВИЧ (качественное исследование) | Не обнаружено |
Аналитическая чувствительность теста составляет 100 копий/мл.
При выявлении ДНК провируса ВИЧ требуются повторные дополнительные исследования для подтверждения ВИЧ-инфекции. При отрицательном результате, но высоком риске инфицирования требуется повторное обследование для исключения ВИЧ-инфекции.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
ВНИМАНИЕ! Для сдачи биоматериала и получения официального результата необходимо иметь при себе паспорт. Дети до 14 лет сдают анализ в присутствии родителей (или законных представителей); при себе необходимо иметь свидетельство о рождении ребенка и паспорт родителя (или законного представителя).
Правила проведения обследования на ВИЧ-инфекцию
» [«serv_cost»]=> string(4) «2650» [«cito_price»]=> NULL [«parent»]=> string(2) «25» [10]=> string(1) «1» [«limit»]=> NULL [«bmats»]=> array(1) { [0]=> array(3) { [«cito»]=> string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(22) «Кровь с ЭДТА» } }}
Источник: https://www.cmd-online.ru/analizy-i-tseny/virus-immunodeficita-cheloveka-opredelenije-dnk-provirusa_032101/
Анализ ДНК на ВИЧ для взрослых и детей: суть исследования, сфера использования

: 14 сен 2016, 13:59
Вирус иммунодефицита является одним из самых опасных заболеваний современности. И неизвестно, что в большей степени огорчает людей – то, что ученые и специалисты в области медицины до сих пор не смогли найти вакцину от страшного недуга, или то, что уровень заболеваемости растет с каждым годом и месяцем.
Большую роль в области исследования СПИДа играет его диагностика. В мировой медицине сегодня используют несколько методов выявления данного недуга. Однако не во всех случаях они оказываются эффективными. Ведь исследование вируса иммунодефицита необходимо и в том случае, когда пациент уже знает о своем диагнозе. Наиболее эффективным для этого считается анализ ДНК ВИЧ.
В чем заключается суть этого исследования, и в каких случаях оно используется?
ПЦР ДНК ВИЧ: суть исследования и подготовка к нему
Анализ ДНК на ВИЧ производится посредством ПЦР.
Полимеразная цепная реакция – это метод, который используется для выявления генетических патологий, инфекций, патогенных микроорганизмов и в том числе, вируса иммунодефицита.
Для исследования у пациента берут кровь из вены. За три-четыре дня до ее сдачи, человеку рекомендуют воздержаться от приема жирной пищи, алкоголя. Забор крови осуществляется натощак.
Провирусная ДНК ВИЧ определяется в несколько этапов. Сыворотку или плазму крови помещают в специальный лабораторный прибор, в котором она расщепляется на молекулы.
Полученную дезоксирибонуклеиновую кислоту пациента сравнивают с ДНК вирусов нескольких типов.
На основании их совпадений или несовпадений можно сделать выводы о наличии и отсутствии заболевания, его типе и количественном составе. Провирусная ДНК ВИЧ норма сравнивается с результатом.
Анализ ПЦР ДНК ВИЧ: сфера использования, достоверность
Как уже говорилось выше, для выявления вируса иммунодефицита метод исследования дезоксирибонуклеиновой кислоты применяется редко. Это дорогостоящий анализ, который не нашел широкого применения в современной медицине. Используется он главным образом в педиатрии. Медикам давно известно, что ДНК содержит ВИЧ.
У детей, которых вынашивали инфицированные матери, заражение происходит разными способами. Речь идет о внутриутробном инфицировании, заражении через родовые пути, а также передаче заболевания через грудное молоко уже после рождения.
Стоит отметить, что около тридцати – тридцати пяти процентов детей, вынашивали и рожали которых инфицированные матери, рождаются здоровыми.
ПЦР ДНК на ВИЧ у них берется в первые десять дней жизни. С помощью этого анализа выясняют, вырабатывает ли организм младенца антитела к вирусу иммунодефицита, а также производят качественное сравнение с генным материалом матери.
Дело в том, что результат иммуноферментного анализа может оказаться положительным, поскольку иммунная система ребенка, находившегося в утробе инфицированной матери, в качестве защитной реакции может вырабатывать антитела к вирусу.
Именно их сравнение с генным материалом матери позволяет определить болен ребенок или здоров.
Для сравнения и определения типа вируса используется ДНК ВИЧ качественный. А для определения вирусной нагрузки производится количественный анализ. Его проводят для того, чтобы узнать, каким образом ведет себя болезнь в той или иной стадии.
Это необходимо для того, чтобы врач принял решение о применении антиретровирусной терапии и правильно подобрал ее схему. Убить ДНК клетки ВИЧ при помощи лекарств, конечно, не удастся, как и избавиться от заболевания.Но с помощью терапии можно существенно продлить латентную стадию недуга и избавить человека от мучительных симптомов.
загрузка…
загрузка…
загрузка…
Интересные материалы по этой теме!
13 сен 2016, 23:03Цель и эффективность РНК ВИЧ-анализа
Вирус иммунодефицита человека – одно из самых страшных заболеваний прошлого и нынешнего столетия. Его изучение, поиск вакцин и препаратов приносят определенные плоды. Однако… 14 сен 2016, 09:53Эффективны ли фракции АСД при псориазе?
Для лечения псориаза не существует стандартной схемы.
Поскольку у каждого пациента заболевание проявляется неодинаково, лечение, подходившее одному больному, может совершенно не помогать другому…. 14 сен 2016, 13:20Какие ванны помогут при псориазе?
На протяжении нескольких веков лекари назначали ванны для лечения псориаза. Современная наука дала объяснение тому, почему купание в воде с различными добавками помогает…
загрузка…
загрузка…
загрузка…
загрузка…
Источник: https://www.zppp.saharniy-diabet.com/vich-spid-1/diagnostika-2/dnk-1
Вич — инфекция

ВИЧ-инфекция — инфекционная болезнь, развивающаяся в результате многолетнего персистирования в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее — ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (СПИД).
Вирус иммунодефицита человека
Вирус иммунодефицита человека — ретровирус из рода лентивирусов, вызывающий медленно прогрессирующее заболевание — ВИЧ-инфекцию.
Вирус поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса, дендритные клетки, клетки микроглии.
В результате работа иммунной системы угнетается и развивается синдром приобретённого иммунного дефицита (СПИД), организм больного теряет возможность защищаться от инфекций и опухолей, возникают вторичные оппортунистические заболевания, которые не характерны для людей с нормальным иммунным статусом.
Без врачебного вмешательства оппортунистические заболевания вызывают смерть пациента в среднем через 9—11 лет после заражения (в зависимости от подтипа вируса). При проведении антиретровирусной терапии продолжительность жизни пациента может быть продлена до 70—80 лет.
К 2019 г. разработана вакцина, «обучающая» иммунную систему организма разрушать оболочку вируса, она проходит тестирование.
История открытия вируса
Синдром приобретенного иммунодефицита (СПИД, AIDS по-английски), вызываемый вирусом иммунодефицита человека (ВИЧ), является смертельной болезнью, средств для лечения которой в настоящее время не существует.
Некоторые ученые считают, что вирус ВИЧ был передан от обезьян к человеку примерно в 1926 году. Последние исследования показывают, что человек приобрел этот вирус в Западной Африке. До 1930-х годов вирус никак не проявлял себя. В 1959 году в Конго умер мужчина.
Позднейшие исследования медиков, проанализировавших его историю болезни, показали, что, возможно, это был первый зафиксированный в мире случай смерти от СПИДа. В 1969 году в США среди проституток были зафиксированы первые случаи болезни, протекавшей с симптомами СПИДа. Тогда медики не обратили на них особого внимания, посчитав редкой формой пневмонии.
В 1978 году у гомосексуалистов в США и Швеции, а также среди гетеросексуальных мужчин в Танзании и на Гаити были обнаружены симптомы одного и того же заболевания.
И только в 1981 году Центр по контролю и профилактике болезней (CDC) сообщил о выявлении у молодых гомосексуалистов в Лос-Анджелесе и Нью-Йорке новой болезни. В США было выявлено около 440 носителей вируса ВИЧ.
Около 200 из этих людей умерли.
Так как большинство больных были гомосексуалистами, новая болезнь получила название «Иммунодефицит, передаваемый гомосексуалистами» (Gay Related Immunodeficiency – GRID) или «Гомосексуальный рак» (A Gay Cancer).
5 июня 1981 года американский ученый из Центра по контролю над заболеваниями Майкл Готлиб впервые описал новое заболевание, протекающее с глубоким поражением иммунной системы.
Тщательный анализ привел американских исследователей к выводу о наличии неизвестного ранее синдрома, получившего в 1982 году название Acquired Immunodeficiency Syndrome (AIDS) – синдром приобретенного иммунодефицита (СПИД).Тогда же СПИД назвали болезнью четырех «Н», по заглавным буквам английских слов – гомосексуалисты (homosexuality), больные гемофилией (hemophilia), гаитяне (Haiti) и героин (heroin), выделив этим самым группы риска для новой болезни.
Иммунный дефицит (снижение иммунитета), от которого страдали заболевшие СПИДом, ранее встречался только как врожденный порок недоношенных новорожденных детей. Врачи установили, что у этих больных снижение иммунитета не было врожденным, но было приобретено в зрелом возрасте.
В 1983 году французским ученым Монтанье была установлена вирусная природа болезни. Он обнаружил в удаленном у больного СПИДом лимфатическом узле вирус, назвав его LAV (lymphadenopathy associated virus).
24 апреля 1984 года директор Института вирусологии человека Мэрилендского университета, доктор Роберт Галло, объявил о том, что он нашел истинную причину СПИДа. Ему удалось выделить вирус из периферической крови больных СПИДом. Он изолировал ретровирус, получивший название HTLV-III (Human T-lymphotropic virus type III). Эти два вируса оказались идентичными.
В 1985 году было установлено, что ВИЧ передается через жидкие среды тела: кровь, сперму, материнское молоко. В том же году был разработан первый тест на ВИЧ, на основе которого в США и Японии начали проверять на ВИЧ донорскую кровь и ее препараты.
В 1986 году группа Монтанье объявила об открытии нового вируса, который получил название HIV-2 (ВИЧ-2). Сравнительное изучение геномов ВИЧ-1 и ВИЧ-2 показало, что в эволюционном плане ВИЧ-2 далеко отстаёт от ВИЧ-1.
Авторы высказали предположение, что оба вируса существовали задолго до возникновения современной эпидемии СПИДа. ВИЧ-2 был впервые выделен в 1985 году от больных СПИДом в Гвинее-Бисау и Островах Зеленого Мыса.Исследования показали, что обусловленные ВИЧ-2 и ВИЧ-1 заболевания являются самостоятельными инфекциями, так как имеются различия в особенностях возбудителей, клинике и эпидемиологии.
В 1987 году Всемирная Организация Здравоохранения утвердила название возбудителя СПИД – «вирус иммунодефицита человека» (ВИЧ, или в английской аббревиатуре HIV).
В 1987 году была учреждена Глобальная программа ВОЗ по СПИДу, а Всемирной ассамблеей здравоохранения принята глобальная стратегия борьбы со СПИДом. В этом же году в ряде стран внедряется в лечение больных первый противовирусный препарат – азидотимидин (зидовудин, ретровир).
Необходимо подчеркнуть, что ВИЧ и СПИД не синонимы. СПИД – понятие более широкое и означает дефицит иммунитета.
Такое состояние может возникнуть в результате самых различных причин: при хронических истощающих заболеваниях, воздействии лучевой энергии, у детей с дефектами иммунной системы и у больных старческого возраста с инволюцией иммунной защиты, некоторых медикаментозных и гормональных препаратов. В настоящее время название СПИД применяется для обозначения только одной из стадий ВИЧ-инфекции, а именно — манифестной ее стадии.
ВИЧ-инфекция — новое инфекционное заболевание, называвшееся до открытия ее возбудителя как синдром приобретенного иммунодефицита (СПИД).
ВИЧ-инфекция — прогрессирующее антропонозное инфекционное заболевание, с кровоконтактным механизмом заражения, характеризующееся специфическим поражением иммунной системы с развитием тяжелого иммунодефицита, который проявляется вторичными инфекциями, злокачественными новообразованиями и аутоиммунными процессами.
Классификация
| Домен | Вирусы |
| Порядок | Ortervirales |
| Семейство | Ретровирусы |
| Подсемейство | Orthoretrovirinae |
| Род | Лентивирусы |
| Группа | Primate lentivirus group |
| Виды | Human immunodeficiency virus 1 (HIV-1)Human immunodeficiency virus 2 (HIV-2) |
Научная классификация ВИЧ
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период.
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10−3 — 10−4 ошибок на геном на цикл репликации, что на несколько порядков больше аналогичной величины у эукариот. Размер генома ВИЧ составляет примерно 104 нуклеотидов.
Из этого следует, что практически каждый дочерний геном хотя бы на один нуклеотид отличается от своего предшественника. В современной классификации различают два основных вида ВИЧ — ВИЧ-1 и ВИЧ-2. Эти вирусы предположительно возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) шимпанзе и мангабеев соответственно.
И ВИЧ-1, и ВИЧ-2 способны вызывать серьёзный иммунодефицит, однако клиническое течение болезни несколько различается. Известно, что ВИЧ-2 менее патогенен и передаётся с меньшей вероятностью, чем ВИЧ-1.Вероятно, это связано с тем, что ВИЧ-2-инфекция характеризуется более низким числом вирусных частиц на миллилитр крови. Отмечено, что инфекция ВИЧ-2 обеспечивает носителю небольшую защиту от заражения ВИЧ-1.
Однако описаны случаи двойной инфекции, причём заражение может происходить в любом порядке. Инфекция ВИЧ-2 реже заканчивается развитием СПИДа.
Есть сведения о несколько большей частоте развития саркомы Капоши, кандидоза ротовой полости и хронической лихорадки при ВИЧ-1/СПИДе. При ВИЧ-2/СПИДе чаще развивается энцефалит, хроническая или бактериальная диарея, серьёзные цитомегаловирусные инфекции и холангит.
ВИЧ-1
ВИЧ-1 описан в 1983 году и является наиболее распространённым и патогенным видом ВИЧ. Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевают ВИЧ-1.
Вид ВИЧ-1 классифицируют на главную группу М и несколько побочных групп. Считается, что группы M, N, O, P образовались в результате независимых случаев передачи SIV от обезьяны к человеку, и последующей мутации вируса до ВИЧ.
- Вирусы группы М (main — основная) являются причиной более 90 % случаев ВИЧ-инфекции. Группу М классифицируют на несколько клад, называемых подтипами, также обозначаемых буквами:
- подтип A широко распространён, например, в Западной Африке и России;
- подтип B доминирует в Европе, Северной Америке, Южной Америке, Японии, Таиланде, Австралии;
- подтип C преобладает в Южной и Восточной Африке, Индии, Непале, некоторых частях Китая;
- подтип D обнаружен только в Восточной и Центральной Африке;
- подтип E не был выявлен в нерекомбинантном виде, лишь совместно с подтипом А как CRF01_AE в Юго-Восточной Азии;
- подтип F выявлен в Центральной Африке, Южной Америке и Восточной Европе;
- подтип G и рекомбинантная форма CRF02_AG выявлены в Африке и Центральной Европе;
- подтип H обнаружен только в Центральной Африке;
- подтип I был предложен для описания штамма-продукта множественной рекомбинации CRF04_cpx нескольких подтипов;
- подтип J распространён в Северной, Центральной и Западной Африке и странах Карибского бассейна;
- подтип K обнаружен только в Конго и Камеруне.
- Группа O (outlier — непохожий) обнаружена в Центральной Африке и Западной Африке. Наиболее распространена в Камеруне, где в 1997 году более 2 % пациентов были заражены вирусом группы О (около 100 000 человек, по данным на 2013 год). Вирусы этой группы не определялись ранними версиями тест-систем на ВИЧ-1; современные тесты определяют вирусы и группы О, и группы N.
- Группа N (non-M, non-O — ни M, ни O) обозначает штаммы не М и не О, описана в 1998 году и обнаружена только в Камеруне. С 2006 года выявлены лишь 10 заражений вирусами группы N.
- Группа P — в 2009 году была определена нуклеотидная последовательность РНК ВИЧ, значительно сходная с вирусом иммунодефицита обезьян, описанным у горилл (SIVgor), но не с SIV, характерным для шимпанзе (SIVcpz). Вирус был выделен из образцов, полученных от женщины камерунского происхождения, проживающей во Франции.
Источник: https://loqify.com/med/zabolevanija/vich-infekcija/
CRISPR/Cas9 как помощник в борьбе с ВИЧ

Статья на конкурс «био/мол/текст»: СПИД и ВИЧ-инфекция до сих пор остаются неизлечимыми заболеваниями, с которыми в мире живут 35 миллионов человек.
Современная терапия, направленная в основном на ингибирование ферментов ВИЧ, никак не влияет на провирус — то есть на ДНК вируса, встроенную в наш геном.
Избавиться от вируса у нас в геноме возможно благодаря революционной системе CRISPR/Cas9, которая позволит вырезать гены ВИЧ.
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Прорывная технология CRISPR/Cas9 и медленный убийца ВИЧ — сверхпопулярные объекты научных и общественных дискуссий, а уж если они пересекаются…
В общем, новость об успешном избавлении лимфоцитов человека от второго объекта с помощью первого бьет рекорды популярности и на нашем конкурсе. Совсем недавно мы опубликовали конкурсную работу на эту тему: «Битва века: CRISPR VS ВИЧ», и вот снова делаем это.
Ну а что: повторенье — мать запоминанья, а главное — соревнование приобретает формы чистого эксперимента: тема одна, изложения — разные!
Еще лет 5 назад никто не мог бы поверить, что появится столь революционный подход к лечению заболеваний. Фурор в мире науки произвела система «натурального» направленного редактирования генома CRISPR/Cas9 [1], [2]. Открыта эта система была почти тридцать лет назад у бактерий, а затем и у архей [3], [4].
Началось все с того, что в геноме микроорганизмов были обнаружены повторяющиеся участки ДНК длиной 20–50 нуклеотидов, неизвестно зачем нужные и разделенные уникальными последовательностями (спейсерами) такой же длины [5]. В непосредственной близости к этим повторам находились гены различных белков, разрезающих и расплетающих ДНК (cаs-гены).
Генетический анализ показал, что эти уникальные участки ДНК гомологичны различным участкам ДНК (протоспейсерам) бактериофагов и плазмид — врагов бактерий. Причем, имея соответствующий спейсер, бактерия становится устойчивой к проникновению чужеродной ДНК [3].
Таким образом, было показано, что CRISPR/Cas система является своеобразной системой бактериального «иммунитета» (рис. 1).На страже иммунитета стоят Cas-белки, которые соединяются с РНК-продуктом транскрипции спейсеров, комплементарным участку гена чужака. Эта РНК — «фоторобот» преступника, с которым полицейский ищет самого преступника. Обнаружив его, полицейский, то есть Cas-белок, разрезает нарушителя [6].
Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета.а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера.
в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК.
ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами.
При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только.
Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.
Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
Жизненный цикл ВИЧ довольно прост (рис. 3).
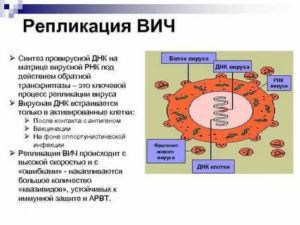
Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].
Рисунок 3. Жизненный цикл ВИЧ.
1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
Терапия ВИЧ
Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса.
Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 106 клеток содержат провирус.
Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].
Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Даже во время приема терапии, вирусные гены могут считываться на некотором уровне, что вызывает различные осложнения у пациентов с ВИЧ-инфекцией, а при прекращении терапии вирус может «активизироваться».
Избавиться от этих болезнетворных записей в нашей ДНК предлагается с помощью системы CRISPR/Cas9, если она будет узнавать участки вирусного генома и их удалять.
Такой подход может привести к полному избавлению от ВИЧ-инфекции (рис. 4).
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8].
В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции.Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
В 2014 году эти исследования провели американские ученые на клетках микроглии, макрофагах и моноцитах, подтвердив успешность такой терапии [9].
Кроме того, ученым удалось иммунизировать клетки от ВИЧ: они добились того, чтобы клетки постоянно содержали систему CRISPR/Cas9 с соответствующей РНК, направленной против ВИЧ (то есть интегрировали ее в геном).
Клеткам это не повредило, и после заражения ВИЧ встраивание в геном и размножение вируса в них не происходило [9], [11], [12]. Кто знает, может, в будущем мы все будем таким образом «вакцинированы» от ВИЧ (рис. 5)?
Не все так просто
Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.
Еще одна проблема — исправление других участков ДНК, похожих на искомую последовательность, или так называемые off-target-эффекты, которые могут затронуть ген, даже если мы не хотели его менять. Эта проблема устранима, если заранее выбирать последовательность, встречающуюся только в гене, который должен стать мишенью Cas9.
Так, в уже упомянутом исследовании ученые, подобрав верную последовательность спейсера, комплиментарную вирусному геному, не обнаружили лишних мутаций в человеческом геноме после применения CRISPR/Cas9 [9].Повысить специфичность можно и другим способом: направлять Cas9 не к одному участку, а к двум близко расположенным участкам гена, разрезая в них не две цепи ДНК сразу, а одну в первой мишени, вторую — во второй (рис. 6). Такие системы называются никазы.
Ответ клетки будет такой же, как при двухцепочечном разрыве ДНК, но специфичность выше, ведь у полицейского теперь два фоторобота преступника [12]. Предлагается также настроить эту систему так, чтобы ее можно было «включать» и «выключать» после использования, чтобы она не работала постоянно в клетке.
И наконец, проблема доставки системы CRISPR/Cas9.
Мы уже научились поставлять ее в отдельные клетки, но как действовать эффективно на уровне организма человека, где около 106 зараженных клеток? Есть разные подходы к такой генной терапии: доставка с помощью вирусных векторов (вирусов, «заражающих» нас хорошими генами), использование наночастиц [13], забор собственных стволовых клеток костного мозга, введение в них CRISPR/Cas9 и последующая обратная трансплантация [9]. При разработке такой терапии стоит также учитывать, что резервуаром вируса служат и клетки головного мозга, куда не так просто проникнуть большим конструкциям [11].
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
- А не замахнуться ли нам на… изменение генома?;
- CRISPR-системы: иммунизация прокариот;
- Немудрый А.А., Валетдинова К.Р., Медведев С.П., Закиян С.М. (2014). Системы редактирования геномов TALEN и CRISPR/Cas — инструменты открытий. Acta Naturae. 6, 20–42;
- Jusiak B., Cleto S., Perez-Piñera P., Lu T.K. (2016). Engineering synthetic gene circuits in living cells with CRISPR technology. Trends Biotechnol. 34, 535–547;
- Wright A.V., Nuñez J.K., Doudna J.A. (2016). Biology and applications of CRISPR systems: harnessing nature’s toolbox for genome engineering. Cell. 164, 29–44;
- Cavanagh P. and Garrity A. (2014). CRISPR/Cas9;
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Ebina H., Misawa N., Kanemura Y., Koyanagi Y. (2013). Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. Sci. Rep. 3, 2510;
- Hu W., Kaminski R., Yang F., Zhang Y., Cosentino L., Li F. et al. (2014). RNA-directed gene editing specifically eradicates latent and prevents new HIV-1 infection. Proc. Natl. Acad. Sci. USA. 111, 11461–11466;
- Saayman S., Ali S.A., Morris K.V., Weinberg M.S. (2015). The therapeutic application of CRISPR/Cas9 technologies for HIV. Expert. Opin. Biol. Ther. 15, 819–830;
- Liao H.K., Gu Y., Diaz A., Marlett J., Takahashi Y., Li M. et al. (2015). Use of the CRISPR/Cas9 system as an intracellular defense against HIV-1 infection in human cells. Nat. Commun. 6, 6413;
- Khalili K., Kaminski R., Gordon J., Cosentino L., Hu W. (2015). Genome editing strategies: potential tools for eradicating HIV-1/AIDS. J. Neurovirol. 21, 310–321;
- Наномеханика для адресной доставки лекарств – насколько это реально?.
Источник: https://biomolecula.ru/articles/crispr-cas9-kak-pomoshchnik-v-borbe-s-vich
