Криоабляция предстательной железы
Органосберегающие технологии при раке предстательной железы
Рак простаты развивается медленно. Считается, что у трети мужчин старше 50 лет и у большинства 80 — летних в простате образуются раковые клетки. У основной массы пациентов патология протекает длительное время бессимптомно. До появления каких-либо клинических признаков проходит много лет. Появилось понятие «клинически незначимый рак ПЖ».
Агрессивные формы, характеризующиеся быстрым прогрессирующим ростом с метастазированием встречаются намного реже.
Чаще выявляются локализованные опухоли, то есть ограниченные самой предстательной железой. С внедрением скринингового контроля и распространением современных методов диагностики число впервые диагностированных локальных форм РПЖ стремительно увеличивается. Однако это явление не привело к росту смертности.
Локализованный рак
Поставив диагноз локализованного рака простаты, врач предлагает пациенту несколько путей решения проблемы, результаты которых практически идентичны. Каждый вариант имеет свои преимущества перед остальными и свои недостатки.
Современная медицина располагает следующими способами лечения рака предстательной железы T1-2:
- радикальное удаление предстательной железы (простатэктомия);
- вапоризация;
- дистанционная лучевая терапия;
- брахитерапия;
- активное наблюдение.
Хирургическое вмешательство
Мировой стандарт лечения предполагает проведение операции. Раньше для удаления предстательной железы производили полостную операцию, сейчас все чаще выбор падает на малоинвазивные вмешательства.
Такой вариант влечет за собой значительно меньшее число последствий и легче переносится пациентом. Существуют методики, при которых нет нужды производить разрез тканей, операционный доступ осуществляется через естественное отверстие – уретру.
Помимо этого получают распространение щадящие органосохраняющие операции: часть простаты сохраняется, улучшая качество жизни.
По статистике после радикальной простатэктомии в течение 25 лет выживает до 80% пациентов. Онкологи во многих случаях производят позадилонное удаление предстательной железы. Вместе с опухолью и тканью железы удалению подлежат также тазовые лимфоузлы. Мобилизация сосудисто-нервного пучка при вмешательстве позволяет сохранить потенцию.
Лимфатические узлы подлежат обязательному гистологическому исследованию. При обнаружении метастатических поражений в регионарных узлах после операции пациент получает гормонотерапию. Хорошие результаты от операции достигаются в случае T1-2NxM0, при T3NxM0 целесообразность операции обсуждается, но она также в некоторых случаях помогает.В прогностическом плане наилучшие результаты наблюдаются в тех случаях, когда сумма баллов по шкале Глисона не превышает 4 (соответствует высокодифференцированным формам рака). Чем ниже степень дифференцировки, тем раньше следует ожидать рецидива опухолевого процесса.
Радикальная простатэктомия (РПЭ)
Является эталоном лечения. Подразумевается удаление всего органа вместе с семенными пузырьками и частью уретры. Цель – ликвидация заболевания.
Основные преимущества:
- Полное удаление опухоли.
- Точное определение стадии и степени злокачественности.
- Снижение беспокойства пациента.
Показания к РПЭ:
- Ожидаемая продолжительность жизни не менее 10 лет.
- Стадия Т1-2N0M0.
- Отсутствие выраженных сопутствующих заболеваний.
- Уровень PSA менее 20 нг/мл.
Насколько эффективна новая методика?
Так называется лечение, направленное на уничтожение патологических тканей с минимальным воздействием на здоровые клетки, проводимое обычно однократно, амбулаторно, почти не имеющее осложнений.
К таким методам относятся:
- Высокочастотный сфокусированный ультразвук (HIFU).
- Криоабляция.
- Радиочастотная абляция (РЧА).
- Лазерная термокоагуляция.
- Фотодинамическая терапия.
- Максимально точно сфокусированная ЛТ (кибер нож).
Малоинвазивные способы предлагаются как альтернатива при противопоказаниях к РПЭ. Однако пациент всегда должен быть информирован, что эти методы лечения рака простаты достаточно новы и долгосрочные исследования их эффективности не проводились.
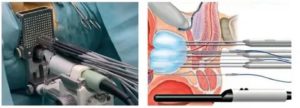
Криоабляция
Это самый изученный и наиболее длительно применяемый метод малоинвазивного воздействия. Через промежность под контролем трансректального УЗИ-датчика вводится специальный криозонд, в котором циркулирует жидкий азот. Испаряясь, он замораживает ткань опухоли, вызывая ее некроз.
Процедура криотерапии длится около 2-х часов. Для защиты мочеиспускательного канала от низких температур в него помещается согревающий зонд.
HIFU терапия
Название — аббревиатура от термина High Intensity Focused Ultrasound – высокоинтенсивный фокусированный ультразвук.
Такой вид воздействия, концентрированный на небольшой площади, приводит к нагреванию опухоли до 70-80 градусов, с последующей ее деструкцией. Окружающие ткани в радиусе 2 мм от края воздействия остаются неповрежденными.
Излучатель ультразвука вводится через прямую кишку. HIFU терапия при раке простаты выполняется под общей или эпидуральной анестезией.
Лечение проводится с помощью внутривенного вливания (в течение 10 минут) препарата, называемого TOOKAD Soluble. Данное вещество нетоксично по отношению к здоровой ткани, окружающей опухоль и не остаётся в организме.
Сразу после введения препарата проводят контролируемое фотодинамическое воздействие на раковую ткань посредством введенного в тело пациента оптоволоконного зонда. Продолжительность такого воздействия составляет 22 минуты.
Воздействие света вызывает цепную реакцию, которая приводит к полному разрушению всей опухоли без повреждения окружающих органов и здоровых тканей (в том числе уретры или нервов, которые контролируют потенцию пациента). Лечебная процедура занимает в целом около полутора часов, лекарственное средство покидает кровоток в течение 3-4 часов.
Испытания метода TOOKAD, показали, что у 80 % пациентов в течение года после такого лечения не было выявлено как опухолей предстательной железы, так и проблем с потенцией или мочеиспусканием. Недавно завершилось европейское клиническое исследование метода, в котором приняли участие более 400 больных из 11 стран.
После лечения пациенты наблюдались на протяжении 2 лет, и в целом метод TOOKAD показал превосходные результаты при отсутствии побочных эффектов.
Министерство здравоохранения Израиля одобрило применение TOOKAD, и проф. Джек Баниель, директор Центра диагностики и лечения рака простаты медицинского центра «Рамат-Авив», провел такую процедуру.
Он заявил: «Мы считаем, что эта операция подходит сотням мужчин. Мы знаем, что Онкологический центр в Нью-Йорке начал проводить клинические испытания метода на пациентах с раком печени и раком пищевода, и мы надеемся, что такое лечение будет эффективным при лечении различных видов рака».Пациент, который прошел в центре «Рамат-Авив» лечение методом TOOKAD, сказал: «Я колебался, выбирая между гормональной и лучевой терапией, так как рак предстательной железы может быть опасным. Но процедура TOOKAD подошла мне идеально. Через десять часов я был уже дома; я практически не чувствовал боли, и рак исчез».
Дистанционная лучевая терапия
Подготовительные мероприятия включают в себя топометрию с применением компьютерной томографии и использованием симулятора. Эти действия направлены на точное определение границы органа. Мишенью для лучевой терапии является сама простата, а иногда еще семенные пузырьки и регионарные лимфоузлы.
Методики проведения лучевой терапии:
- четырехпольное облучение;
- трехпольное облучение;
- передняя ротация с одного поля;
- трехмерная конформальная лучевая терапия.
В течение 7 недель пациент получает как минимум 65-70 Гр (иногда до 74-76 Гр). Как и случае с радикальной простатэктомией, выживаемость пациентов в продолжение 5 лет достигает 75-80%. Прогноз напрямую зависит от степени дифференцировки опухоли (оценка по шкале Глисона) и концентрации простатического специфического антигена (ПСА).
Гормонотерапия
РПЖ – это гормонально зависимая опухоль, и влияет на нее в первую очередь тестостерон. Это мужской половой гормон, 90% которого вырабатывается в яичках.
Регулируется выработка тестостерона сложным гуморальным механизмом с участием гипоталамо-гипофизарной системы (стимулируют его ЛГ и ЛГРГ).
Достигая клеток предстательной железы, он превращается в дигидротестостерон, который в десятки раз активнее.
Снижение уровня андрогенов способствует замедлению или остановке роста РПЖ.
Уменьшить концентрацию мужских половых гормонов можно следующими способами:
- Хирургическая кастрация (удаление обоих яичек) – орхиэктомия.
- Применение аналогов ЛГРГ – химическая кастрация (диферелин, гозелерин и др).
- Терапия антагонистами ЛГРГ (дегареликс).
- Препараты, блокирующие андрогены (флутамид, бикалутамид).
- Применение женских половых гормонов – эстрогенов.
Гормонотерапия как единственный метод лечения может рассматриваться только в качестве паллиативной меры при распространенном раке простаты или при рецидиве после радикального лечения. В основном же он применяется как компонент комбинированного лечения, дополняющего радикальные методы – простатэктомию и лучевую терапию.
Применяться такой метод может как до операции или ДЛТ с целью уменьшения объема простаты), так и после радикального воздействия в группах с высоким риском рецидива.
Двусторонняя орхиэктомия
До сих пор является «золотым стандартом» гормонального лечения.
Преимущества:
- Быстрое снижение концентрации тестостерона (в течение нескольких часов).
- Технически несложная операция, может быть проведена в амбулаторных условиях.
- Невысокая стоимость.
Показания:
- Распространенный РПЖ с метастазами.
- Локализованный рак при невозможности провести радикальное лечение.
- Как адъювантный метод после РПЭ или ЛТ.
Последствия гормональной терапии и орхидэктомии
- Снижение полового влечения.
- Увеличение и болезненность грудных желез (гинекомастия).
- Приливы жара.
- Остеопороз и частые переломы.
- Атрофия мышц.
- Повышение уровня холестерина и риска сердечно-сосудистых осложнений.
- Нервно-психические расстройства, депрессия.
- Развитие через некоторое время нечувствительности опухоли к антиандрогенной терапии.
Местнораспространенный рак
Характеризуется выходом опухоли за предел простаты, T3-4N0M0, T1-4N1M0. Стандарт лечения такого рака – лучевая терапия, хотя и этот метод вызывает в научном обществе появление дискуссий. Мишенью становится не только простата, но и тазовые лимфатические узлы, в которых не исключено наличие микроскопических метастазов.
Пациент получает дозу облучения 70 Гр. Значительно лучшие результаты показало сочетание лучевой и гормональной терапии. В настоящее время эта методика активно изучается. Радикальная простатэктомия при T3 считается методом выбора у пациентов молодого возраста с высокодифференцированной опухолью и низким уровнем ПСА.
Тактика в зависимости от стадии
Опасность патологии в том, что на начальной стадии рака простаты негативная симптоматика полностью отсутствует. Мужчина не ощущает ни дискомфорта, ни затруднений с мочеиспусканием либо половым влечением.
К настораживающим проявлениям недуга можно отнести, прежде всего, неестественно учащенные позывы на опорожнение мочевого пузыря, особенно в ночное время, а также затрудненность самого процесса выведения мочи. Болезненные ощущения могут наблюдаться далеко не всегда. В моче присутствуют элементы крови и спермы.
Однако, подобные симптомы часто относятся мужчинами к возрастным изменениям в простате – аденоме, простатиту, и попросту игнорируются. И только при переходе патологии на следующий этап, когда болевые импульсы становятся продолжительными и более интенсивными, перемещаются в район крестца, отдают в ноги, представители сильной половины человечества обращаются за медицинской помощью.
Выбор лечения при РПЖ зависит от стадии заболевания, состояния пациента, оснащенности медучреждения. Значение имеет информированность и настроенность самого больного.
Цели лечения:
- При локализованной форме – радикальное удаление или полная регрессия опухоли.
- Местнораспространенный рак – стабилизация роста, частичная или полная регрессия.
- При метастатическом РПЖ – увеличение продолжительности жизни, улучшение общего состояния.
I стадия РПЖ
- Выжидательная тактика.
- Активное наблюдение.
- Радикальная простатэктомия, возможно с последующей ЛТ.
- Наружная лучевая терапия.
- Брахитерапия.
- Малоинвазивные способы (криотерапия, HIFU, кибер-нож).
II стадия
Применяются те же методы, возможно подключение гормональной терапии в комбинации с ЛТ.
III стадия
- Удаление предстательной железы с тазовыми лимфоузлами, последующей ЛТ.
- Дистанционная лучевая терапия.
- Гормональное лечение после РПЭ, ДЛТ, или при противопоказаниях к радикальным методам.
- Выжидательная тактика.
- Гормональная терапия.
- Орхидэктомия.
- Химиотерапия.
- Паллиативное лучевое лечение.
- Паллиативные хирургические вмешательства (ТУР, наложение эпицистостомы, нефростомы).
- Адекватное обезболивание.
- Бифосфонаты при метастазах в кости.
- Симптоматические средства.
Тактика при рецидивах
- При повторном росте опухоли после ДЛТ выполняется РПЭ.
- Химиотерапия.
- Гормональное лечение.
- Орхидэктомия.
- ДЛТ на ложе удаленной железы при рецидивах после РПЭ.
Источник: https://prostatitnik.ru/organosberegayushchie-tekhnolo/
Криоабляция: как и где проводится, эффективность

Криоабляция – это метод лечения раковых опухолей с помощью замораживания. Под действием отрицательных температур клетки погибают и лишаются питания.
Метод используют как альтернативу операции при противопоказаниях или если опухоль расположена в труднодоступном для скальпеля месте.
Также холодом обрабатывают область перед операцией, чтобы образование уменьшилось и стало доступнее для удаления.
Оборудование
Криоабляцию называют криотерапия, или чрескожная абляция. Точнее будет назвать метод криодеструкцией, так как действие минусовой температуры направлено на уничтожение клеток рака. Особенность терапии – в малой инвазивности.
Оборудование криотерапии представляет собой консоль, к которой подсоединена баллонная система, криозонд и бронхоскоп. Введение криозонда контролируют с помощью КТ или МРТ.
Для автоматического расчета дозировки встроено электронное устройство.
Криозонд – тонкий манипулятор с одной или несколькими иглами на конце. Бронхоскоп – тонкая трубка, на конце которой прикреплена видеокамера и светодиод. Инструмент используют для обследования дыхательных путей.
Для криотерапии используют азот или аргон. Аргон действует мягче и его использование одобрено Министерством здравоохранения.
В ходе процедуры применяют средства УЗИ, электрокардиограф, в зависимости от поражённого органа.
Система криоабляции размещается в специальном помещении.Криозонд вводится через кожу или через хирургический разрез. Также замораживают образования на поверхности кожи. Процедура делается под местным или общим наркозом. Газ подается в криозонд. Температура от -90 до -150 градусов.
Область применения
Криоабляция применяется против:
- Опухолей внутренних органов;
- Кожных образований, невусов;
- Глазных заболеваний.
С помощью метода лечат рак молочных желёз, почек, простаты, костей, позвоночника. Метод эффективен для нормализации работы сердца при фибрилляции, тяжёлыми последствиями которой становятся инсульты и инвалидность.
Заморозке подвергается не только опухоль, но и окружающие ткани и сосуды. Клетка опухоли не получает питательные вещества и разрушается под действием холода. Малые опухоли исчезают без дополнительного вмешательства. Замораживание помогает остановить раковый рост больших структур. После уменьшения их удаляют хирургически.
Лечение раковых заболеваний
Для определённого органа положена специальная температура. Время воздействия тоже отличается.
Предстательная железа
Криотерапия используется в трёх случаях:
- При противопоказании к удалению простаты;
- При неспособности переносить лучевую и брахитерапию;
- Для локального воздействия на небольшие образования.
Возможное побочное действие – импотенция.
Эффективность – умеренная.
Почки
При температуре воздействия -40 градусов проводят несколько этапов замораживания и оттаивания. Умеренная эффективность метода против небольших образований снижает вероятность рецидива. При этом сохраняется функционирование почки. После операции почечная функция снижается на 26%, после радиочастотной абляции – на 13%, а после криотерапии – всего на 6%.
Процедура криоабляции в почке
Сердце
Метод используют для восстановления проводимости электроимпульса. Экстремальному охлаждению подвергаются сердечные ткани и пути, нарушающие движение импульса, что ведет к аритмии.
Криоабляция сердца делается с помощью введения криокатетера или манипулятора через хирургический разрез. Криокатетер – тонкая трубка, которую вводят в сердце через вену на ноге. Второй метод – хирургический способ криотерапии на открытом сердце.
Чтобы добиться максимального эффекта лечения фибрилляции предсердий, участки замораживают точечно. В ходе процедуры изолируют устья лёгочных вен, отключая их от сердца. Используют две техники – точка по точке и криобаллонная абляция.
Печень
Криозонд вводят через кожу в орган под местной анестезией и контролем УЗИ и рентгеноскопии. Температура -100 или -150 градусов подаётся в течение двух минут. Криоабляция печени безболезненна, в отличие от метода РЧА.
Молочные железы
Криоабляция применяется наиболее часто против фиброаденомы. Доброкачественная опухоль состоит из железистой ткани, пронизанной фиброзными волокнами. Дополнительно может использоваться сканер УЗИ.
Последовательность процедуры:
- Наблюдая через сканер УЗИ, в опухоль вводят иглу криоманипулятора;
- Область с опухолью замораживается, превращаясь в ледяной шар.
В результате клетки опухоли разрушаются, образование съёживается и исчезает, постепенно заменяется соединительной тканью. Остатки уничтожают иммунные клетки.
Замораживание опухоли в матке
Криоабляция фиброаденомы молочной железы проводится со средним уровнем заморозки при местной анестезии. Преимущество процедуры перед хирургической операцией – на молочных железах не останется шрамов.
Кожа
Холод подается на образование. Обработанный участок оттаивает. Потом злокачественные ткани отслаиваются естественным путём.
Особенности лечения
Пациенты легко переносят процедуру. Сложности возникают при инвазивных вмешательствах на открытых органах. В этом случае необходим общий наркоз, присутствие анестезиолога.
Особенности криотерапии:
- Период реабилитации после местной зондовой терапии – три дня.
- Восстановление после абляции на открытых органах займёт 7 дней.
- Первое время необходимо избегать физических нагрузок и подъёма тяжестей в течение месяца.
Таковы общие рекомендации. Сроки восстановления увеличиваются или уменьшаются в пределах двух-трех дней. Также врач дает индивидуальные рекомендации каждому пациенту.
Анестезия
При местном наркозе пациент ощутит укол от первого введения зонда. В ходе процедуры отсутствуют неприятные ощущения, кроме зуда в области разреза.
Для обезболивания нижнего отдела позвоночника применяется спинальная анестезия. Обезболивающее вводят в спинномозговое пространство.
Ещё один способ анестезии, которой применяют – общая седация. В отличие от полного отключения сознания при общем наркозе, во время седации сознание пациента затуманено, как после ночного пробуждения.
Перед процедурой назначают антибиотик, чтобы исключить заражение инфекцией.
Положительные стороны
Криоабляция раковых опухолей имеет свои положительные стороны и недостатки. Реакция на лечение зависит от стадии заболевания, структуры опухоли.
Преимущества:
- Позволяет быстро восстановиться после любого вида процедуры;
- Отсутствие болезненных ощущений, как при облучении;
- Минимум травматичности по сравнению с обычной операцией.
Для введения манипулятора нужен маленький разрез. После его заживления не остаётся рубцов.
Отрицательные стороны
Сложности проведения процедуры:
- Риск кровотечения в месте прокола, а также в паренхиматозных органах – печени, почках, лёгких;
- Сопутствующие повреждения;
- Скопление жидкости вокруг лёгких при работе в области диафрагмы;
- При работе на лёгком – его спадение;
- Повреждение холодом нервов;
- Реакция организма на анестезию.
Перед криоабляцией необходимо провести анализ крови на свертываемость, как и перед хирургической операцией. До процедуры необходимо отменить приём антикоагулянтов, а также биодобавок, аспирина, йодированных и нестероидных противовоспалительных препаратов.
Женщинам необходимо предупредить врача, который проводит процедуру, о возможной беременности.
Побочные действия
При работе на печени повреждают желчные протоки. Обработка предстательной железы может повредить кишечник. Если подвергаются криоабляции почки, есть риск задеть окружающие ткани.
Побочные эффекты криоабляции простаты:
- Импотенция – кроме тканей криодеструкция оказывает воздействие на нервы, однако возможно их постепенное естественное восстановление;
- Зажим мочевыводящего катетера в просвете уретры во время процедуры;
- Задержка мочи из-за шелушения слизистой мочеиспускательного канала в ответ на введение катетера.
При криоабляции происходит таяние обработанного участка. У пациента может возникать ощущение обморожения, сопровождающееся выделением жидкости из места введения манипулятора.
Цена и эффективность
Стоимость процедуры зависит от вида рака и страны, в которой находится кардиологическая клиника. Средняя цена за рубежом:
- Рак кожи – 200-5000 у.е.;
- Рак предстательной железы – 5000-15000 у.е.;
- Рак лёгких – 2500 у.е.
Стоимость процедуры на сердце в Москве – 400000-850000 р.
После криоабляции реже возникают рецидивы, чем после хирургической операции и облучения. Но против метастазов метод использовать нельзя, так как манипулятор охватывает узко ограниченную область.
Криоабляция не имеет противопоказаний и противопоставляется химиотерапии как более щадящий метод лечения рака. Статистика результатов проведенных исследований эффективности процедуры показывает, что лечение почек заморозкой уменьшает риск рецидива на 11-14%.
Источник: https://onko.guru/medic/krioablyatsiya.html
Лечение рака простаты

I. Операция
- Радикальная простатэктомия.
- Лапароскопическая радикальная простатэктомия.
II. Традиционное
- Активное отслеживание динамики.
- Лечение гормонами.
III. Малоинвазивные способы терапии:
- Криоабляция.
- Фокус интенсивного ультразвука (HIFU).
IV. Лучевой метод
Активное наблюдение
Такая методика подразумевает периодическое комплексное обследование и выявление порога ПСА (раз в 3 месяца) без терапевтического вмешательства до момента проявления симптоматики или повышения параметра сверх нормы.
Назначение:
- РПЖ (Т1–Т2);
- индекс Глисона £ 7;
- порог ПСА < 15–20 нг/мг.
Как определить прогресс новообразования?
- Интервал удвоения ПСА с пороговым значением от £ 2 до £ 4 лет;
- рост индекса Глисона до ³ 7 при следующей биопсии, после 1–4 лет.
Лечение рака простаты консервативными способами уместно при возрастном ограничении, у пациентов от 70 лет с определенной (Т1 а) стадией болезни и потенциальной длительностью жизни максимум 10 лет. Эти проявления нередко становятся очевидными после ТУР относительно аденомы простаты.
Развитие заболевания произойдет только у 10-25% диагностированных в продолжение 10 лет, и довольно редко болезнь распространяется за 5-летний период.
Если рак высоко дифференцирован, новообразование возрастает и распределяется довольно умеренно, и многим пациентам зрелого возраста не нужно проходить терапию в контексте активного наблюдения.
Но есть и ряд оговорок по поводу того, какую терапию выбрать, если диагностирован рак простаты. Лечение не должно ограничиваться выжиданием и консервативными методами на ранних стадиях (Т2), вследствие рисков распространения метастазов и опасности летального исхода.
Сегодня доказана целесообразность применения методов активного наблюдения в случае локально проявленных видов рака простаты – радикальной простатэктомии (РПЭ) и облучения.
Радикальная простатэктомия
Этот способ признан главным при лечении рака простаты. ПЖ устраняется целостным блоком с семенными пузырьками и парапростатической клетчаткой так, чтобы получить отрицательный хирургический край.
Нередко в ходе операции с двух сторон удаляют тазовые лимфоузлы.
При локально выявленном заболевании и предполагаемой длительности жизни от 10 лет важно удалить новообразование с сохранением способности мужчины удерживать мочу и, желательно, эректильного потенциала. Операция не предполагает ограничений по возрасту.
Наоборот, множество попутных заболеваний усиливают риски летального исхода, вне связи с РПЖ. Крайне важно выявить потенциальную длительность жизни в ходе наблюдения и консультирования пациента.
Сегодня РПЭ признан уникальным способом, допускающим лечение рака простаты с преимуществом в канцер-специфической выживаемости, если сопоставлять с наблюдением и выжиданием. Хирургическая практика дает возможность минимизировать проявления осложнений РПЭ и повысить статистический уровень излечения.
Назначение РПЭ:
- локально проявленные формы болезни (Т1-2, иногда Т3);
- потенциальная длительность жизни от 10 лет;
- переносимость наркоза.
Осложнения (выявлены в 30-100% наблюдений):
- ослабление (исчезновение) эректильной функции, исходя из возраста мужчины и методики оперативного вмешательства (нервосберегающее либо нет);
- неспособность к удержанию мочи в 2-18% случаях после операции (у 27,5% – в лёгкой форме).
В чем плюсы процедуры?
- Относительно низкая инвазивность,
- снижение кровопотери,
- качественное воссоздание анатомических фрагментов в ходе операции;
- сокращение времени госпитализации и восстановления.
Минусы:
- потребность в специфическом оснащении и инструментах,
- долгий период подготовки компетентных медицинских кадров.
Показания – локально проявленный рак простаты при прогнозируемой длительности жизни мужчины, минимум, 10 лет.
Противопоказания:
- сбои в свёртывании крови;
- явные искажения дыхательной активности и работы сердца;
- общее инфицирование;
- гнойники и воспаления на брюшной передней стенке.
Условные противопоказания:
- чрезмерный вес;
- специфический размер простаты (до 20 см3 и от 80 см3);
- неоадъювантная терапия;
- сделанные до этого операции на простате (ТУР, чреспузырная или позадилонная аденомэктомия).
Все перечисленные условия осложняют выделение простаты и провоцируют осложнения.
Сегодня пока еще нет отдалённых онкологических данных относительно лапароскопической простатэктомии. Но есть основания полагать, что одинаково эффективны открытая и лапароскопическая простатэктомия. Положительный хирургический край выявлен исходя из стадии рака предстательной железы в 11-50%. Лечение дает возможность 5-летней выживаемости в 99,1%, причем на 3 года без рецидивов – в 90,5%.
Сопоставление лапароскопической радикальной простатэктомии (ЛРПЭ) с открытой радикальной простатэктомией (РПЭ):
- сокращенное время госпитализации;
- уменьшение количества осложнений, структур уретры и анастомоза;
- равная потребность в послеоперационной адъювантной терапии;
- снижение числа осложнений в мочеполовой сфере, снижение частотности недержания мочи и нарушений эрекции.
Этапы ЛРПЭ.
- Размещение троакаров.
- Обеспечение рабочей зоны посредством баллонного дилятатора.
- Рассечение внутренней тазовой фасции.
- Наложение лигатур на дорзальный венозный комплекс.
- Отсечение простаты с семенными пузырьками от мочевого пузыря.
- Рассечение фасции Доненвилля, «холодным» путем, очень аккуратно, во избежание травм прямой кишки.
- Клипсы для нервосберегающего пересечения латеральных ножек.
- Пересечение уретры и дессекция верха простаты с применением «холодных» ножниц.
- Наложение анастомоза между уретрой и шейкой мочевого пузыря.
- криоабляция;
- очень интенсивный направленный ультразвук (HIFU).
- стадия cT1b–T2a N0, M0;
- индекс Глисона ≤ 6 при биопсии из удовлетворительного количества точек;
- порог ПСА до терапии ≤ 10 нг/мл;
- ≤ 50 % положительных столбиков;
- размеры ПЖ < 50 см3;
- общее число баллов по IPSS ≤ 12.
- подавлением производства андрогенов яичками хирургической или медикаментозной кастрацией;
- подавлением функции циркулирующих андрогенов на уровне их рецепторов в клетках ПЖ, с применением конкурентных ингибиторов – антиандрогенов (Дифереллина, Золадекса, Элигарда, Флутамида и др.).
Реализуют два вида процедур: позадилонный и промежностный. Они схожи степенью вмешательства, дальнейшей выживаемостью, частотой положительных хирургических краёв. Поэтому итоговое решение вырабатывается персонально, с учетом рекомендаций уролога.
Альтернативные способы
Сегодня самые популярные малоинвазивные методы:
Высокоинтенсивный сфокусированный ультразвук (HIFU)
С этой целью применяют преобразователь, направляющий ультразвук на ткани, чтобы повредить их благодаря механическому и температурному воздействию и эффекту кавитации. Важно довести температуру ткани новообразования более 65 °C, что разрушит ее.
Радикальное облучение
Трехмерная конформная лучевая терапия (3D-КЛТ) относится к классическим методам лечения, однако более современная вариация – ЛТ с модуляцией интенсивности (ЛТМИ).
Анатомические данные, взятые в ходе сканирования, транслируются в программу 3-мерного моделирования, позволяющую видеть клиническую картину облучения и потом добавить в его пределах безопасный отступ.
Коллиматор автоматически и при ЛТМИ постоянно поправляет контуры облучаемой зоны, фиксируемые лучами. Такой контроль в режиме реального времени дает возможность сопоставлять зону воздействия и смоделированное поле, менять отклонения, когда они более 5 мм.Усиливается эффект локального лечения вследствие усиления дозы без возрастания угроз осложнений.
При ЛТМИ допустимо применять линейный ускоритель, оборудованный современным многолепестковым коллиматором и специализированным ПО. Движение лепестков в ходе операции дает возможность усложнять распределение дозы в зоне облучения и снижать негативное воздействие лучей на прямую кишку.
Трансперинеальная брахитерапия
Обеспечивает защиту и эффект лечения РПЖ, подразумевает примерно 2-дневное пребывание в стационаре.
Есть согласование по ряду критериев отбора:
Операция проводится под контролем ТРУЗИ, когда пациент лежит плашмя в гинекологической позе. Имплантируют источники под общим наркозом или спинальным блоком.
Терапия гормонами
Базовые понятия
Клетки предстательной железы физиологически обусловлены андрогенами, активизирующими их рост, функциональность и пролиферацию. Тестостерон здесь выполняет ведущую функцию, регулируя динамику опухоли. Производство подавляющего числа андрогенов у мужчин обеспечивается яичками, и лишь 5–10 % из них вырабатываются надпочечниками.
Выделение тестостерона координирует гипоталамо-гипофизарно-гонадная система. В клетках ПЖ тестостерон трансформируется в 5-α-дигидротестостерон (ДГТ), и он в 10 раз более активен. На периферии тестостерон обретает запах и трансформируется в эстрогены, вместе с циркулирующими андрогенами обеспечивающие негативный обратный эффект секреции гипоталамусом ЛГРГ.
Блокирование андрогенной стимуляции клеток ПЖ ведет к их смерти. Все типы терапии, снижающие активность андрогенов, считают андрогенной депривацией.
Она провоцируется:
Приведенные способы допустимо сочетать с целью наибольшей (или полной) андрогенной блокады (МАБ).
Источник: https://uroprof.com/therapy/rak-predstatelnoy-zhelezy/
Лечение рака предстательной железы
- Что такое рак простаты у мужчин
- Рак простаты излечим
- Рак без операции: препараты
- Новое в лечении рака простаты
- Иная терапия при раке
Диагностированная онкология – это всегда страшные новости, особенно если речь идет о том, что онкологический процесс поражает такую сложную и уязвимую «деталь» мужского организма, как простата, нормальная деятельность которых жизненно необходима для поддержки работоспособности двух важнейших сфер – мочевыделительной и половой.
Эффективное лечение рака предстательной железы проводится как существующими средствами, так и разработками новых методов воздействия, и все равно вопрос, как лечить опухоль простаты в 100% случаев, остается проблемой сложной и важной.
Существует эффективное лечение рака предстательной железы как существующими средствами, так и разработками новых методов
Что такое рак простаты у мужчин
Рак простаты у мужчин представляет собой злокачественное опухолевое образование, получающие развитие из клеток предстательной железы и способное дать метастазы.
Чаще всего опухоль начинает развиваться у мужчин в возрасте старше 60 лет (соответствующий диагноз имеет каждый сотый пациент), хотя высока вероятность заболевания и для представителей сильного пола, перешагнувших 35-летний рубеж (опухоль предстательной железы диагностируется у 1 из 10000).
Из всех разновидностей злокачественных поражений различных органов именно рак простаты лечения требует в максимальном количестве случаев.
Наши читатели рекомендуют
Наш постоянный читатель избавился от ПРОСТАТИТА действенным методом. Он проверил его на себе — результат 100% — полное избавление от простатита. Это натуральное средство на основе меда. Мы проверили метод и решили посоветовать его Вам. Результат быстрый. ДЕЙСТВЕННЫЙ МЕТОД.
Причины, по которым раковый процесс поражает мужской организм, специалистами до конца все еще не изучены.
Принято считать, что новообразование злокачественного характера может развиваться только тогда, когда предстательная железа уже повреждена хроническими недугами и иными патологическими изменениями, спровоцировавшими нарушения в клеточной структуре. Дополнительными факторами, провоцирующими болезнь, являются:
- гормональный сбой или перестройка (с определенного возраста в мужском организме начинается избыточное производство мужских половых гормонов, на «базе» которых происходит увеличение железы в размерах и аномальный рост опухолевых клеток);
- относительно безобидные изменения (после излечения аденомы простаты часто остаются «лишние» доброкачественные клетки, способные при определенных условиях мутировать в злокачественные);
- воспалительные заболевания (хронический простатит провоцирует проблемы с кровообращением в органах малого таза, из-за чего начинается производство «вредных» клеточных структур).
Также опухоль при раке простаты может развиться в случаях, когда клетки этого органа подвергаются «атаке» собственной иммунной системы больного человека или болезнетворными микроорганизмами, из-за чего происходит внесение неправильной информации в генетический отдел ядра клетки и ее превращение в раковую клетку.
Рак простаты излечим
Первый вопрос, который слышит лечащий врач от человека с поставленным диагнозом: «Излечим ли рак простаты?». Ответить на него крайне сложно, так как терапия при раке этой (да и любой другой) разновидности будет успешной только в случае своевременного обращения за помощью.
Излечение более или менее полное может быть при обнаружении злокачественного новообразования на ранней стадии, излечиваться на поздних сроках также возможно, но уже, только если будет задействован более серьезный способ терапии (в основном хирургический).
В любом случае лечение рака простаты должно начинаться с обращения больного к врачу, а это происходит обычно только после проявления основных признаков начала заболевания.
Рак простаты симптомы достаточно заметные и специфические проявляет, к сожалению, только тогда, когда болезнь заходит уже слишком далеко.
На ранних стадиях свидетельством начала патологического процесса в мужском организме может быть признак, аналогичный симптому доброкачественного увеличения предстательной железы в размерах (в ходе простатита или аденомы).
В дальнейшем проявляться злокачественное новообразование может сбоями в мочеиспускании, его болезненностью и затрудненностью, кровью в моче.
По мере прогрессирования онкологии к замеченным клиническим проявлениям добавляются симптомы инфекций мочевыделительной системы (повышение температуры, озноб, боль при мочеиспускании), а также общее истощение организма с аномально-быстрой потерей веса, что свидетельствует о начале интоксикации всего организма.Рак предстательной железы симптомами и лечением на ранней стадии схож с любым другим типом поражения данного органа. Только благодаря тщательно проведенной диагностике при аденоме простаты могут быть обнаружены морфологические признаки онкологии на 1 стадии развития.
В ходе пальпации железы при подозрении на простатит (с последующим подтверждением результатами биопсии) может быть выявлена опухоль на 2 стадии.
При перечисленных выше симптомах и дополнительно проведенных диагностических исследованиях подтверждается диагноз на 3 и 4 стадиях болезни.
Ответить на вопрос, можно ли вылечить рак простаты, лечащему врачу достаточно сложно, так как в каждом конкретном случае ему приходится учитывать многие факторы, начиная со степени развития обнаруженного заболевания, заканчивая историей болезни пациента.
Можно ли вылечить рак простаты, лечащему врачу ответить сложно, так как в каждом конкретном случае ему приходится учитывать многие факторы
Рак без операции: препараты
Обнаруженное на раннем этапе прогрессирования, заболевание достаточно эффективно лечится без операции. При раке предстательной железы 1-2 стадии успешно применяется гормональная терапия, направленная на подавление выработки большого количества мужских половых гормонов.
Использование соответствующих препаратов позволяет снизить в организме больного концентрацию гормонов-андрогенов, вследствие чего опухоль будет ограничена в «строительном материале», и развитие рака приостановится.
Важно: даже на последних стадиях развития лечение рака предстательной железы лечением гормональным будет полезным, так как с его помощью врачам удастся продлить срок жизни пациента и облегчить состояние.
Более того, часто воздействие гормонами представляет собой единственное средство, например, для мужчин в пожилом возрасте, когда оперативное вмешательство, равно как и связанные с хирургическими манипуляциями методы лечения рака простаты представляют опасность для жизни.В гормональной терапии обычно используются:
- препараты, относящиеся к группе антагонистов гонадотропин-рилизинг гормона, снижающие уровень тестостерона, не просто тормозящие развитие опухоли, но и обращающие процесс новообразования вспять, то есть делающие раковые клетки простаты похожими на здоровые;
- медикаменты, являющиеся аналогами гипофизарного гормона, в течение нескольких недель понижающих уровень мужских гормонов практически до нуля (временное явление);
- средства, предотвращающие связь онкологических клеток с гормонами надпочечников, что также снижает количество «строительного материала» для злокачественного новообразования и замедляет его развитие.
При условии своевременного лечения и выполнения пациентом всех предписаний, включая диету, физиотерапию и здоровый образ жизни, ему удается не просто доказать тот факт, что усилиями современной медицины рак простаты излечим – вылечившийся мужчина сохранит жизнь, включая полноценное функционирование половой сферы.
При раке предстательной железы могут использовать не только гормональные медикаменты, но и препараты с моноклональными антителами – белками, очень близкими по структуре к тем, что в идеальном случае организм для подавления опухоли должен вырабатывать самостоятельно. Применяемая пока только за рубежом иммунотерапия рака показывает достаточно неплохие результаты.
Новейшие методы лечения рака предстательной железы включают воздействие на злокачественное образование средствами так называемой виротерапии.
Это достаточно перспективное направление представляет собой разработку специальных видов вирусов, задачей которых является обнаружение раковых клеток, внедрение в них и инициация процесса их растворения.
Уже тестируются соответствующие препараты, на ранних этапах заболевания способные стимулировать угнетение опухоли и усиление иммунитета больного, что необходимо для подготовки к оперативному вмешательству и после хирургических манипуляций.
Новейшие методы лечения рака предстательной железы включают воздействие на злокачественное образование средствами так называемой виротерапией
Новое в лечении рака простаты
Методы гормональной терапии и лечения с применением новейших фармакологических разработок в целом являются особенно эффективными в сочетании с новейшими инструментальными разработками.
Так, например, в дополнение к лекарствам часто используется криотерапия.
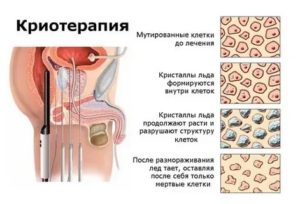
Криоабляция простаты (так называется эта процедура) представляет собой замораживание участков опухоли посредством воздействия низких температур, вследствие чего раковые клетки превращаются в кристаллы льда и разрушаются.
Самое новое в лечении рака простаты – фокальная терапия, при которой с помощью специальных инструментальных методик производится точечное воздействие на очаги опухоли в железе, а не всю поверхность. Наиболее успешно в последние годы карцинома побеждается посредством уничтожения «стратегических» участков наведенными через фокус фотоактивными веществами или ультразвуком (HIFU).
В ходе фокальной фотодинамической терапии под контролем ультразвука пациенту, находящемуся под общим наркозом, вводится внутривенно фотоактивное вещество, активация которого происходит в тот момент, когда оно попадает в простату.Активное действие вещества провоцируется лазерным лучом, направляемым к точному участку локализации очага опухоли по специальному световодному каналу. Перед началом процедуры проводится тщательное обследование пациента с целью выявления точного расположения участков железы, пораженных раком.
Фотодинамическая терапия позволяет перекрыть кровеносные сосуды, оплетающие новообразование и снабжающие его кислородом, в результате чего опухоль разрушается.
ФУЗ (HIFU, фокальная терапия рака простаты ультразвуковым воздействием) представляет собой более «продвинутую» методику воздействием ФУВИ (фокусированным ультразвуком высокой интенсивности).
В ходе процедуры HIFU специалисты в режиме реального времени создают трехмерное изображение результатов ультразвука и снимка МРТ (мощное магнитное поле дает максимально четкие данные), на основе которых особая роботизированная система прицельно (с точностью до миллиметра) «расстреливает» опухолевый очаг, не затрагивая нервные или иные структуры.
При раке предстательной железы относительно раннего этапа прогрессирования применение метода HIFU обеспечит предохранение организма от развития метастазов.
При радикальной терапии используется хирургия (радикальная простатэктомия)
Иная терапия при раке
На поздних стадиях развития и при наличии у пациента соответствующих показаний (например, сопутствующих проблем со здоровьем) лечение рака предстательной железы бывает более серьезным, чем прием лекарств и инструментальные методики. Для радикальной терапии используются три основных метода:
- хирургия (радикальная простатэктомия);
- радиотерапия наружная;
- брахитерапия (лучевая терапия внутренняя).
Лечение злокачественного образования в простате методом хирургического вмешательства предусматривает выполнение хирургом разреза в брюшной полости (нижней части) или в промежности, через который железа удаляется целиком.
Чуть менее агрессивным методом является орхиэктомия при раке – удаление яичек (так как в них происходит выработка максимального количества гормона тестостерона, их отсутствие позволит снизить количество «строительного материала» для опухоли).
Часто в дополнение к хирургическому вмешательству того или иного рода добавляется радиотерапия (облучение тканей, в которых находились очаги рака).
При наружной радиотерапии злокачественное новообразование облучается точными пучками высокоэнергетического рентгеновского излучения.Данный метод может считаться достаточно опасным, так как излучение от особого линейного ускорителя попадает к онкологическим очагам через внешние ткани, однако, максимальная доза фокусируется только в нужном месте, рассеиваясь при прохождении через мышцы, ткани и кости.
Брахитерапия предусматривает облучение опухоли следующим образом: в капсулу простаты помещается несколько радиоактивных зерен, которые оказывают воздействие на очаги, находясь в непосредственной близости к ним. Процедура проводится в течение нескольких минут и часто ее оказывается достаточно для полной победы над раком.
У специалистов в областях урологии и онкологии, с каждым годом сталкивающихся со все большим количеством случаев рака простаты, в современном мире имеется много практики.
Кроме того, чем больше обнаруживается больных людей, тем большее внимание уделяется разработке новых способов оказания помощи им.
Уже внедрены такие инновационные технологии, как HIFU, исследуются возможности привлечения к терапии вирусов и синтетических белков, успешно проводятся сложнейшие хирургические операции. И на этом врачи не остановятся.
Источник: https://funkit.ru/predstatelnaya_zheleza/rak/lechenie-raka-predstatelnoj-zhelezy.html
Опыт лечения рака предстательной железы при помощи криоаблации
Говоров А.В.1, Пушкарь Д.Ю.1, Иванов В.Ю.2 1 Кафедра урологии Московского государственного медико-стоматологического университета;
2ГКБ № 50, Москва.
Введение и цель исследования
Криотерапия представляет собой аблацию ткани путём локального воздействия очень низкой температуры. Более полное определение этого термина предложено B.Patel и соавт.
, которые считают криоаблацию процессом локального замораживания и девитализации тканей, позволяющим прицельно создать зону некроза необходимой формы и размера для деструкции поражённой ткани и прилежащих по краю здоровых клеток [1]. В 1996 г.
Американская ассоциация урологов признала криоаблацию простаты методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной. В «Guidelines» Европейской ассоциации урологов 2011 г. отмечено, что криоаблация представляет собой альтернативный, минимально-инвазивный, высокоэффективный способ лечения РПЖ.
В 2008 г. J.Jones и соавт. представили данные Регистра COLD (Cryo On-Line Database) о биохимической безрецидивной выживаемости у больных РПЖ разных групп риска согласно критериям D'Amico [2].
При использовании критерия биохимического рецидива Phoenix [3], 5-летняя выживаемость пациентов низкого, среднего и высокого риска составила 91,1%, 78,5% и 62,2% соответственно. По данным J.Cohen и соавт., 10-летняя выживаемость 204 больных без биохимического рецидива согласно критерию Phoenix в группах низкого, среднего и высокого риска равнялась 80,56%, 74,16% и 45,54% соответственно [4].
Целью нашего исследования было проанализировать результаты криоаблации простаты у больных РПЖ на начальном этапе освоения методики.
История, принципы и описание методики криоаблации простаты
Первая криоаблация простаты была проведена в 1966 г. M.Gonder и соавт.
с использованием одного трансуретрального датчика (иглы) 26 Fr для лечения инфравезикальной обструкции, вызванной увеличением предстательной железы [5].
Частота осложнений (ректальной фистулы, отхождение струпа слизистой оболочки уретры) такого рода терапии была высока вследствие отсутствия контроля над ходом замораживания простаты.
Рост популярности криоаблации предстательной железы был отмечен повторно в 1993 г. после публикации G.Onik и соавт. работы о введении игл и контроле за формированием в простате т.н.
«ледяного шара» при помощи трансректального ультразвукового исследования (ТРУЗИ) в режиме реального времени [6]. Недостатком ТРУЗИ являлась невозможность контроля за температурой внутри и на границе «ледяного шара». В 1994 г. F.Lee и соавт.
были разработаны температурные сенсоры, обеспечившие точное достижение требуемой температуры, что привело к значительному росту эффективности лечения [7].
Другим важным фактором, способствовавшим успеху криотерапии, стало внедрение в 1995 г. в практику уретрального катетера, согревающего слизистую уретры, что отразилось в урежении частоты недержания мочи и отхождения струпа мочеиспускательного канала.
Основными факторами, обеспечивающими действие на ткань низкой температуры, являются механический и осмотический эффекты, а также клеточная гипоксия.
При криоаблации происходят денатурация белка вследствие дегидратации, переход внутриклеточной воды в экстрацеллюлярное пространство и разрыв клеточных мембран из-за образования кристаллов льда.
Создаётся токсическая концентрация внутриклеточных компонентов; после быстрого замораживания и медленного оттаивания наступают термальный шок, сосудистый стаз, усиливается апоптоз [8] В работах K.Tatsutani и соавт. [9], а также A.Gage и соавт. [10] было показано, что быстрое замораживание ткани и медленное оттаивание усиливают деструкцию раковых клеток, а повторный цикл замораживание / оттаивание обеспечивает более выраженную гибель клеток.
При выполнении криоаблации простаты пациента укладывают в положение для литотомии. Мочевой пузырь дренируют по уретре катетером Фоли для лучшей визуализации уретры и шейки мочевого пузыря.
Выполняют ультразвуковое исследование простаты трансректальным биплановым ультразвуковым датчиком, закрепленным в стабилизирующем пошаговом устройстве с координатной решеткой. Под ультразвуковым контролем в ткань предстательной железы трансперинеально вводят криоиглы и температурные датчики.
Также температурные датчики устанавливают в зону наружного сфинктера и фасции Денонвилье. После имплантации игл для исключения перфорации стенки уретры и мочевого пузыря выполняют фиброцистоскопию.
В уретру устанавливают катетер, согревающий уретру, и выполняют 2 или 4 цикла замораживания/оттаивания (в зависимости от размеров предстательной железы и используемых игл). В завершение операции мочевой пузырь дренируют по уретре катетером Фоли № 16 или 18 по Шарьеру.
Материал и методы исследования
Источник: https://www.mpamed.ru/info/publications/lechenie-raka-s-pomoschy-crio/
